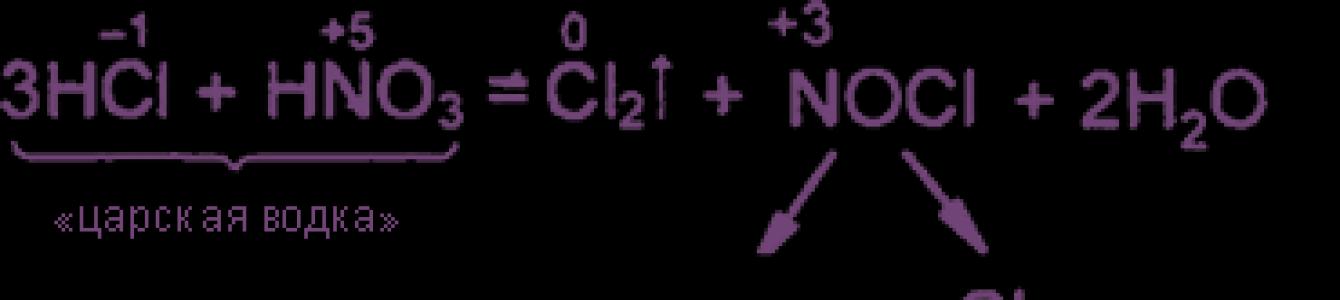В табл. 16.12 приведены систематические и традиционные названия кислородсодержащих кислот хлора и их солей. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и силакислоты:
5 - сильные кислоты, причем 6 одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и
Таблица 16.12. Кислородсодержащие кислоты хлора и их анионы
существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только 7 удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием егостепени окисления:
8 - особенно хорошие окислители. Например, кислый раствор 9:
1) окисляет ионы железа (II) до ионов железа (III):
2) на солнечном свету разлагается с образованием кислорода:
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат 10-ионы:
Соли кислородсодержащих кислот хлора
Эти соли обычно более устойчивы, чем сами кислоты. Исключением являются твердые соли хлораты (III), которые детонируют при нагревании и при соприкосновении с горючими материалами. В растворах окислительная способность кислородсодержащих солей хлора тем больше, чем больше в этих соляхстепень окисления хлора. Однако они не являются столь хорошими окислителями, как соответствующие кислоты. Натриевые и калиевые соли 11 имеют важное промышленное значение. Их производство и применения описаны в следующем разделе. Хлорат (V) калия обычно используют для лабораторного получения кислорода, в присутствии оксида 12 в качестве катализатора:
При нагревании этой соли до более низкой температуры в отсутствие катализатора происходит образование 13калия:
Иодат (V) калия 14 калия 15 сильные окислители, и в качестве окислителей они используются в количественном анализе.
Итак, повторим еще раз 1. Свойства галогенидов различных элементов при перемещении слева направо в пределах одного периода изменяются следующим образом: а) характер химической связи становится все более ковалентным и все менее ионным; б) водные растворы галогенидов становятся все более кислыми из-за гидролиза. 2. Свойства различных галогенидов одного и того же элемента при перемещении к нижней части VII группы изменяются следующим образом: а) характер химической связи галогенидов становится все более ковалентным: б) прочность связи в молекулах галогеноводородов уменьшается; в) кислотность галогеноводородных кислот уменьшается; г) легкость окисления галогеноводородов возрастает. 3. По мере возрастания степени окисления галогена происходят следующие изменения: а) термическая устойчивость его кислородсодержащих кислот возрастает; б) кислотность его кислородсодержащих кислот возрастает; в) окислительная способность его кислородсодержащих кислот уменьшается; г) окислительная способность солей его кислородсодержащих кислот возрастает. 4. Галогениды можно получать прямым синтезом из образующих их элементов. 5. Для получениигалогеноводородов может использоваться реакция вытеснения из галогенидной соли менее летучей кислотой. 6. Аномальные свойства соединений фтора: а) фторид серебра растворим в воде, а фторид кальция нерастворим; б) фтороводород имеет аномально высокие температуры плавления и кипения; в) водный раствор фтороводорода имеет низкую кислотность; г) фтор обнаруживает только одно устойчивое состояние окисления. Другие галогены обнаруживают множество состояний окисления, что объясняется промотированием их16 -электронов на легко доступные 17-орбитали, обладающие низков энергией.
===============================================================================
31. Кислород. Получение и свойства кислорода. Аллотропия кислорода. Озон, его свойства. Озон в природе.
Кислород-элемент с порядковым номером 8, его относительная атомная масса=15,999.Находится во втором периоде, в главной подгруппе 6 группы.
В большинстве своих соединений кислород имеет степень окисление -2.В пероксидах водорода и металлов(Н2О2, Na2O, CaO2 и др.)степень окисления кислорода -1.Существует единственное соединение, в котором кислород имеет положительную степень окисления +2-это фтроид кислорода OF2 (фтор-единственный элемент, ЭО которого больше ЭО кислорода, равной 3,5). Обычный кислород О2-газ без цвета и запаха, тяжелее воздуха. В воде малорастворим. Получение. Лабораторные методы
получения О2 достаточно многочисленны. 1.Раздожение бертолетовой соли(хлората калия) при нагревании в присутствии оксида марганца(IV) в качестве катализатора: 2KClO3(t)(MnO2)=2KCl + 3O2
2.Термическое разложение перманганата калия: 2KMnO4(t)=K2MnO4 + MnO2 + O2
3.Термическое разложение нитратов щелочных металлов, например: 2NaNo3(t)=2NaNO2 + O2 4.Каталитическое разложение пероксида водорода: 2H2O2(MnO2)=2H2O + O2
5.Взаимодействие пероксидов щелочных металлов с углекислым газом: 2Na2O2 + 2CO2=2NaCO3 + O2 6.Электролиз водных растворов щелочей или солей кислородосодержащих кислот. Сущность происходящих при этом процессов сводится к разложению воды под действием электрического тока: 2H2O(электролиз)=2H2 + O2
В промышленности кислород получают из воздуха. Химические свойства.
Кислород образует соединения со всеми химическими элементами, кроме легких инертных газов(He, ne, Ar),причем со всеми простыми веществами, кроме фтора, хлора, золота и платиновых металлов, он взаимодействует непосредственно. Во всех реакциях O2играет роль окислителя. При взаимодействии кислорода с простыми веществами -металлами и неметаллами- обычно образуются оксиды; например: 4Li+O2=2LiO2 4P+5O2(60 градусов)=2P2O5 Почти все реакции с участием O2 экзотермичны, за редким исключением; например: N2+O2=2NO-Q Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3. Аллотропия (от греч. allos - другой и tropos - образ, способ) связана либо с разным числом атомов в молекуле, либо со строением. При сравнении физических свойств кислорода и озона целесообразно вспомнить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде. Кислород в нормальных условиях - газ, без цвета и запаха, озон - газ голубого цвета с характерным резким, но приятным запахом. Есть отличия и в химических свойствах.
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании: Но в то же время и озон и кислород реагируют с активными металлами, например с калием К. Получение озона происходит по следующему уравнению: Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон - неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека. Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
Химические свойства
: озон – сильный окислитель, он окисляет все металлы, в том числе золото – Au и платину – Pt (и металлы платиновой группы). Озон воздействует на блестящую серебряную пластинку, которая мгновенно покрывается черным пероксидом серебра – Аg2О2; бумага, смоченная скипидаром, воспламеняется, сернистые соединения металлов окисляются до солей серной кислоты; многие красящие вещества обесцвечиваются; разрушает органические вещества – при этом молекула озона отщепляет один атом кислорода, и озон превращается в обыкновенный кислород. Атакже большинство неметаллов, переводит низшие оксиды в высшие, а сульфиды их металлов – в их сульфаты: Йодид калия озон окисляет до молекулярного йода: Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя: В химическом отношении молекулы озона неустойчивы – озон способен самопроизвольно распадаться на молекулярный кислород:
Нахождение в природе : в атмосфере озон образуется во время электрических разрядов. Применение: будучи сильным окислителем озон уничтожает различного рода бактерии, поэтому широко применяется в целях очищения воды и дезинфекции воздуха, используется как белящее средство.
================================================================================
32) . Пероксид водорода, его строение и свойства.
Хлор
Фтор
Главная подгруппа VII группы
У элементов главной подгруппы, которые называются "галогены", на внешнем электронном уровне, имеющем общее строение...ns 2 p 5 , не достает одного электрона до устойчивого восьмиэлектронного уровня. Энергия сродства к электрону достаточно велика и галогены очень активны по отношению к металлам и неметаллам. Бурно идут реакции с водородом, образующиеся галогеноводороды растворяясь в воде дают кислоты сила которых растет сверху вниз по группе. Фтор, не имеющий d-подуровня, проявляет в своих соединениях только степень окисления -1, остальные галогены могут проявлять степени окисления -1, +1, +3, +5, +7.
В природе встречается в виде CaF 2 – флюорит, KHF 2 – бифторид. Простое вещество F 2 в промышленности получают электролизом расплава бифторида. F 2 - газ желтоватого цвета с удушающим запахом, крайне ядовит, химически чрезвычайно активен.
Химические свойства
1. Фтор взаимодействует со всеми простыми веществами, кроме гелия, неона и аргона:
3F 2 + Cl 2 = 2ClF 3 ;
3F 2 + S = SF 6 ;
5F 2 + 2P = 2PF 5 ;
2. При взаимодействии F 2 со щелочами образуется фторид кислорода (OF 2):
2F 2 + 2NaOH = 2NaF + OF 2 + H 2 O
OF 2 - бесцветный газ, по запаху напоминает озон, сильно ядовит. Это единственное соединение, где кислород имеет степень окисления +2.
3. Так как взаимодействие F 2 + H 2 = 2HF происходит со взрывом, фтористый водород получают не прямым синтезом, а по реакции:
CaF 2 + H 2 SO 4(конц) = CaSO 4 + 2HF
HF - легко кипящая жидкость (Т кип. = +20 о С), с водой смешивается в любых соотношениях. 40%-ный раствор HF в воде называется плавиковой кислотой. Плавиковая кислота – кислота средней силы. Это вещество одно из самых опасных по физиологическому воздействию: ядовита, при попадании на кожу вызывает долго не заживающие язвы, разрушает зубы. Органику обугливает эффективней серной кислоты.
В растворе молекулы плавиковой кислоты сильно ассоциированы за счет водородных связей. Наиболее прочны димеры, поэтому правильнее записывать формулу плавиковой кислоты следует в виде H 2 F 2 . Известны многочисленные соли этого димера (KHF 2 и др).
4. Практическое значение имеет реакция взаимодействия плавиковой кислоты с оксидом кремния (он входит в состав стекла):
SiO 2 + 4HF = SiF 4 + 2H 2 O
Эта реакция лежит в основе нанесения узоров и рисунков на стекло.
Применение . F 2 используется при производстве фторорганических соединений, например фторопласта (тефлона). Тефлон - белый плотный полимер, устойчивый во всех агрессивных средах вплоть до +350 o С. Фтор придает высокую эластичность резине в интервале температур от -80 о С до +200 о С.
В природе встречается в виде различных соединений, основным из которых является NaCl – поваренная соль, электролизом водного раствора которой на аноде получают хлор. Простое вещество Cl 2 - газ желто-зеленого цвета. При -34 о С легко сжижается. Ядовит. Плохо растворим в воде.
Химические свойства
1. Хлор обладает несколько меньшим сродством к электрону, чем фтор, однако остается очень активным неметаллом. Многие реакции с участием Cl 2 идут со взрывом. Cl 2 является сильным окислителем. Не реагирует с кислородом, углеродом, азотом. Вступает в реакции со сложными молекулами:
2NO + Cl 2 = 2NOCl – хлористый нитрозил;
CO + Cl 2 = COCl 2 – фосген;
Хлорированием метана в промышленности получают следующие соединения:
CH 4 + Cl 2 = CH 3 Cl – хлористый метил
CH 3 Cl + Cl 2 = CH 2 Cl 2 – хлористый метилен
СH 2 Cl 2 + Cl 2 = CHCl 3 – хлороформ
CHCl 3 + Cl 2 = CCl 4 – четыреххлористый углерод
2. Хлористый водород можно получить прямым синтезом из простых веществ:
Cl 2 + H 2 = 2HCl
эта реакция относится к фотохимическим, т. е. идущая под действием света.
В лабораторных условиях хлористый водород обычно получают из NaCl при нагревании с концентрированной серной кислотой:
NaCl + H 2 SO 4(конц) = NaHSO 4 + HCl
Хлористый водород – газ с резким запахом, хорошо растворимый в воде с образованием соляной кислоты (предел растворимости 38%). Соляная кислота сильнее, чем плавиковая, не ядовита. В концентрированном состоянии является восстановителем:
K 2 Cr 2 O 7 + 14HCl (конц) = 2KCl + 2CrCl 3 + 3Cl 2 + 7H 2 O
HClO – хлорноватистая кислота. Ей соответствует кислотный оксид Cl 2 O. Соли называются гипохлоритами.
HClO 2 – хлористая кислота. Кислотный оксид Cl 2 O 3 не получен. Соли – хлориты.
HClO 3 – хлорноватая кислота. Кислотный оксид Cl 2 O 5 не получен. Соли – хлораты.
HClO 4 – хлорная кислота. Кислотный оксид - Cl 2 O 7 . Соли – перхлораты.
1) HClO – желтоватая жидкость. Существует только в растворах. Получается при взаимодействии хлора с водой (без нагревания):
Cl 2 + H 2 O = HCl + HClO
Соли этой кислоты получаются при действии на щелочь хлора:
2KOH + Cl 2 = KClO + KCl + H 2 O
используется как отбеливатель в текстильной промышленности.
2) HClO 2 , HClO 3 – не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в пиротехнике и взрывных работах. Наибольшее значение имеет KClO 3 – хлорат калия (бертолетовая соль), получаемая насыщением горячей щелочи хлором:
3Cl 2 + 6KOH = KClO 3 + 5KCl + 3H 2 O
Хлораты - сильнейшие окислители. При ударе или нагревании взрываются.
3) Известен оксид ClO 2 , который можно получить по реакции:
2KClO 3 + H 2 C 2 O 4 = K 2 CO 3 + CO 2 + H 2 O + 2ClO 2
ClO 2 – зелено-желтый газ, при растворении в воде дает смесь кислот:
2ClO 2 + H 2 O = HClO 2 + HClO 3
4) Осторожным нагреванием хлораты можно перевести в перхлораты, из которых можно получить хлорную кислоту:
KClO 4 + H 2 SO 4 = HClO 4 + KHSO 4
Хлорная кислота HClO 4 – подвижная жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти все ее соли хорошо растворимы в воде.
5) В ряду HClO - HClO 2 - HClO 3 - HClO 4 сила кислот растет, а окислительная способность падает.
Хлор находит широкое применение в химической промышленности для получения хлористого водорода и соляной кислоты, синтеза хлорорганических веществ, обеззараживания питьевой воды, в текстильной промышленности для отбеливания тканей, в производстве ядохимикатов.
Cl 2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (~ 6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Способы получения
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl 2 0
Промышленный
Электролиз водных растворов хлоридов, чаще - NaCl:
2NaCl + 2Н 2 O = Cl 2 + 2NaOH + H 2
Лабораторные
Окисление конц. HCI различными окислителями:
4HCI + MnO 2 = Cl 2 + МпCl 2 + 2Н 2 O
16НСl + 2КМпО 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8Н 2 O
6HCl + КСlO 3 = ЗCl 2 + KCl + 3Н 2 O
14HCl + К 2 Сr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7Н 2 O
Химические свойства
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Cl 2 0 + 2e - = 2Cl -
Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Cl 2 + Сu = CuCl 2
3Cl 2 + 2Аu = 2AuCl 3
Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O 2 , N 2 , С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Cl 2 + Н 2 =2НС1
Cl 2 + 2S (расплав) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (или РCl 5 - в избытке Cl 2)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 = 2ICl 3
Вытеснение свободных неметаллов (Вr 2 , I 2 , N 2 , S) из их соединений
Cl 2 + 2KBr = Br 2 + 2KCl
Cl 2 + 2KI = I 2 + 2KCl
Cl 2 + 2HI = I 2 + 2HCl
Cl 2 + H 2 S = S + 2HCl
ЗСl 2 + 2NH 3 = N 2 + 6HCl
Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO 3 - .
Cl 2 + Н 2 O = HCl + НClO хлорноватистая к-та
Cl 2 + 2КОН =KCl + KClO + Н 2 O
3Cl 2 + 6КОН = 5KCl + KClO 3 + 3Н 2 O
3Cl 2 + 2Са(ОН) 2 = CaCl 2 + Са(ClO) 2 + 2Н 2 O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO 3 и Са(ClO) 2 - гипохлориты; КClO 3 - хлорат калия (бертолетова соль).
Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl 2 по месту разрыва кратных углерод-углеродных связей
H 2 C=CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-дихлорэтан
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
Газообразный хлороводород
Физические и химические свойства
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F 2 = Сl 2 + 2HF
4HCl + O 2 = 2Сl 2 + 2Н 2 O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Способы получения
1. Синтез из простых веществ:
Н 2 + Cl 2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl 2 = R-Cl + HCl
3. В лаборатории получают действием конц. H 2 SO 4 на хлориды:
H 2 SО 4 (конц.) + NaCl = 2HCl + NaHSО 4 (при слабом нагревании)
H 2 SО 4 (конц.) + 2NaCl = 2HCl + Na 2 SО 4 (при очень сильном нагревании)
Водный раствор HCl - сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н 2 O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
HCl → H + + Cl -
Взаимодействие:
а) с металлами (до Н):
2HCl 2 + Zn = ZnCl 2 + H 2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl 2 + Н 2 O
6HCl + Аl 2 O 3 = 2АlCl 3 + ЗН 2 O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН) 2 = CaCl 2 + 2Н 2 О
3HCl + Аl(ОН) 3 = АlСl 3 + ЗН 2 O
г) с солями более слабых кислот:
2HCl + СаСО 3 = CaCl 2 + СO 2 + Н 3 O
HCl + C 6 H 5 ONa = С 6 Н 5 ОН + NaCl
д) с аммиаком:
HCl + NH 3 = NH 4 Cl
Реакции с сильными окислителями F 2 , MnO 2 , KMnO 4, KClO 3, K 2 Cr 2 O 7 . Анион Cl - окисляется до свободного галогена:
2Cl - - 2e - = Cl 2 0
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:

Реакции с органическими соединениями
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH 2 + HCl → + Cl -
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислотные оксиды

Кислоты

Соли
Химические свойства
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.

Хлорная известь
Хлорная (белильная) известь - смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H 2 O
 Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. +1 Сl 2 О Т. Пл о. С Т. кип °С -120, 6 +3 +4 +4 +5 +6 +7 Сl 2 О 3 Сl. O 2 Сl 2 O 4 Сl 2 O 5 Сl 2 O 6 Сl 2 O 7 не получен НСl. О 2 -117 9, 7 2, 0 -59 не получен 44, 5 -93, 4 203 НСl. О 3 3 87 НСl. О 4 хлорнова хлористая тистая хлорнова тая сильная очень сильная гипохлориты хлораты Na. Cl. O 2 КСl. О 3 перхлораты слабая средней силы хлорная КСl. О 4
Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. +1 Сl 2 О Т. Пл о. С Т. кип °С -120, 6 +3 +4 +4 +5 +6 +7 Сl 2 О 3 Сl. O 2 Сl 2 O 4 Сl 2 O 5 Сl 2 O 6 Сl 2 O 7 не получен НСl. О 2 -117 9, 7 2, 0 -59 не получен 44, 5 -93, 4 203 НСl. О 3 3 87 НСl. О 4 хлорнова хлористая тистая хлорнова тая сильная очень сильная гипохлориты хлораты Na. Cl. O 2 КСl. О 3 перхлораты слабая средней силы хлорная КСl. О 4
 § Все соединениям с хлором в положительных степенях являются очень сильными окислителями. § Наиболее сильно окислительные свойства выражены у хлорноватистой кислоты, хотя она слабая и неустойчивая. § Свободные кислородсодержащие кислоты хлора неустойчивы и, кроме хлорной кислоты, существуют только в растворе. Все они являются сильными окислителями. § Сила кислот и их окислительные свойства различные понятия. § В ряду HCl. O - HCl. O 2 - HCl. O 3 - HCl. O 4 устойчивость и сила кислот растет, а реакционная способность уменьшается.
§ Все соединениям с хлором в положительных степенях являются очень сильными окислителями. § Наиболее сильно окислительные свойства выражены у хлорноватистой кислоты, хотя она слабая и неустойчивая. § Свободные кислородсодержащие кислоты хлора неустойчивы и, кроме хлорной кислоты, существуют только в растворе. Все они являются сильными окислителями. § Сила кислот и их окислительные свойства различные понятия. § В ряду HCl. O - HCl. O 2 - HCl. O 3 - HCl. O 4 устойчивость и сила кислот растет, а реакционная способность уменьшается.
 Отношение галогенов к воде ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие, F 2 − окислитель, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие, Cl 20 − окислитель, восстановитель; реакция – диспропорционирования, ü Br 20 + H 2 O ↔ HBr +1 O + HBr − 1 хорошо растворим, взаимодействия практически не происходит; Br 20 − окислитель, восстановитель; реакция – диспропорционирования, ü I 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит; ü At 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит
Отношение галогенов к воде ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие, F 2 − окислитель, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие, Cl 20 − окислитель, восстановитель; реакция – диспропорционирования, ü Br 20 + H 2 O ↔ HBr +1 O + HBr − 1 хорошо растворим, взаимодействия практически не происходит; Br 20 − окислитель, восстановитель; реакция – диспропорционирования, ü I 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит; ü At 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит
 Оксиды хлора Параметр сравнения Оксид хлора (I) хлора (IV) Агрегатное состояние при н. у. , цвет Буроватожелтый газ; при t°
Оксиды хлора Параметр сравнения Оксид хлора (I) хлора (IV) Агрегатное состояние при н. у. , цвет Буроватожелтый газ; при t°
 Параметр сравнения Оксид хлора (I) Оксид хлора (IV) Оксид хлора (VII) Термическая устойчивость Термически неустойчив, разлагается на свету Термически очень неустойчив Медленно разлагается при комнатной температуре Наиболее устойчивый оксид хлора, разлагается при нагревании до 120°С Токсичность Ядовит, поражает дыхательные пути Токсичный Сильно ядовит Токсичный Отношение к воде Хорошо растворяются, взаимодействуют с водой
Параметр сравнения Оксид хлора (I) Оксид хлора (IV) Оксид хлора (VII) Термическая устойчивость Термически неустойчив, разлагается на свету Термически очень неустойчив Медленно разлагается при комнатной температуре Наиболее устойчивый оксид хлора, разлагается при нагревании до 120°С Токсичность Ядовит, поражает дыхательные пути Токсичный Сильно ядовит Токсичный Отношение к воде Хорошо растворяются, взаимодействуют с водой
 Методы получения оксидов хлора Оксид хлора Название метода, УХР Оксид хлора (I) Взаимодействие оксида ртути (II) c хлором при 0°С: Hg. O(твердый) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O Оксид хлора (IV) 1) Взаимодействие хлората калия со щавелевой кислотой: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2 + CO 2 + H 2 O (лабораторный метод); 2) Пропускание сернистого газа SO 2 в подкисленный раствор хлората натрия: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2 (промышленный метод) Оксид хлора (VI) Окисление оксида хлора (IV) озоном: 2 Cl. O 2+2 O 3 = 2 O 2 + Cl 2 O 6 Оксид хлора (VII) Взаимодействие хлорной кислоты с фосфорным ангидридом – оксидом фосфора (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7
Методы получения оксидов хлора Оксид хлора Название метода, УХР Оксид хлора (I) Взаимодействие оксида ртути (II) c хлором при 0°С: Hg. O(твердый) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O Оксид хлора (IV) 1) Взаимодействие хлората калия со щавелевой кислотой: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2 + CO 2 + H 2 O (лабораторный метод); 2) Пропускание сернистого газа SO 2 в подкисленный раствор хлората натрия: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2 (промышленный метод) Оксид хлора (VI) Окисление оксида хлора (IV) озоном: 2 Cl. O 2+2 O 3 = 2 O 2 + Cl 2 O 6 Оксид хлора (VII) Взаимодействие хлорной кислоты с фосфорным ангидридом – оксидом фосфора (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7
 Химические свойства оксидов хлора Cl 2 O – оксид хлора (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не ОВР, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не ОВР, Cl. O 2 – оксид хлора (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ОВР, Cl+4 – и восстановитель, и окислитель 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ОВР, Cl+4 – и восстановитель, и окислитель Cl 2 O 6 – оксид хлора (VI) Cl 2+6 O 6 + H 2 O = HCl+5 O 3 + HCl+7 O 4 ОВР, Cl+6 – и восстановитель, и окислитель Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ОВР, Cl+6 – и восстановитель, и окислитель Cl 2 O 7 – оксид хлора (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не ОВР, а Cl 2+7 O 7 + 2 KOH = 2 KCl+7 O 4 + H 2 O не ОВР,
Химические свойства оксидов хлора Cl 2 O – оксид хлора (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не ОВР, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не ОВР, Cl. O 2 – оксид хлора (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ОВР, Cl+4 – и восстановитель, и окислитель 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ОВР, Cl+4 – и восстановитель, и окислитель Cl 2 O 6 – оксид хлора (VI) Cl 2+6 O 6 + H 2 O = HCl+5 O 3 + HCl+7 O 4 ОВР, Cl+6 – и восстановитель, и окислитель Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ОВР, Cl+6 – и восстановитель, и окислитель Cl 2 O 7 – оксид хлора (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не ОВР, а Cl 2+7 O 7 + 2 KOH = 2 KCl+7 O 4 + H 2 O не ОВР,
 Кислородсодержащие кислоты хлора Физические свойства, методы получения Химические свойства– отношение к нагреванию, растворам щелочей и к основным оксидам
Кислородсодержащие кислоты хлора Физические свойства, методы получения Химические свойства– отношение к нагреванию, растворам щелочей и к основным оксидам
 Кислородсодержащие кислоты хлора Формула кислоты Степень окисления Cl в кислоте НСl+1 О НCl+3 O 2 НCl+5 O 3 НCl+7 O 4 +1 +3 +5 +7 Увеличивается Термическая устойчивость Увеличивается Сила кислоты Увеличивается Очень слабая кислота Слабая кислота частично диссоциирует в воде Форма существования Кислота средней силы, ближе к сильным Одна из самых сильных кислот диссоциирует практически необратимо существуют только в растворе выделена в свободном виде
Кислородсодержащие кислоты хлора Формула кислоты Степень окисления Cl в кислоте НСl+1 О НCl+3 O 2 НCl+5 O 3 НCl+7 O 4 +1 +3 +5 +7 Увеличивается Термическая устойчивость Увеличивается Сила кислоты Увеличивается Очень слабая кислота Слабая кислота частично диссоциирует в воде Форма существования Кислота средней силы, ближе к сильным Одна из самых сильных кислот диссоциирует практически необратимо существуют только в растворе выделена в свободном виде
 Хлорноватистая кислота получается при растворении оксида хлора (I) в воде (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хлорноватистая кислота − хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора) (2): (2) Cl 2 + H 2 O ⇌ HCl. O + HCl Образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода - сильный окислитель, применяется для обеззараживания воды и отбеливания тканей.
Хлорноватистая кислота получается при растворении оксида хлора (I) в воде (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хлорноватистая кислота − хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора) (2): (2) Cl 2 + H 2 O ⇌ HCl. O + HCl Образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода - сильный окислитель, применяется для обеззараживания воды и отбеливания тканей.
 Хлористая кислота Раствор кислоты получают из её солей − хлоритов Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ А также по реакции: 2 Cl. O 2 + Н 2 O → НCl. O 2 + НCl. O 3 Хлористая кислота является кислотой средней силы, ближе к слабой Хлориты используют для отбеливания.
Хлористая кислота Раствор кислоты получают из её солей − хлоритов Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ А также по реакции: 2 Cl. O 2 + Н 2 O → НCl. O 2 + НCl. O 3 Хлористая кислота является кислотой средней силы, ближе к слабой Хлориты используют для отбеливания.
 Хлорноватая кислота водных растворах при концентрации ниже 30% на холоду довольно устойчива; в более концентрированных растворах распадается: В 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хлорноватая кислота - сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры, например в 40%-ной кислоте воспламеняется, фильтровальная бумага. Хлорноватую кислоту в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой: Ba(Cl. O 3)2 + H 2 SО 4 = Ba. SO 4↓+ 2 HCl. O 3.
Хлорноватая кислота водных растворах при концентрации ниже 30% на холоду довольно устойчива; в более концентрированных растворах распадается: В 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хлорноватая кислота - сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры, например в 40%-ной кислоте воспламеняется, фильтровальная бумага. Хлорноватую кислоту в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой: Ba(Cl. O 3)2 + H 2 SО 4 = Ba. SO 4↓+ 2 HCl. O 3.
 Хлорная кислота Безводная хлорная кислота получается при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой или водных растворов хлорной кислоты с олеумом, а также при взаимодействии оксида хлора (VII) с водой: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + Н 2 O → 2 НCl. O 4
Хлорная кислота Безводная хлорная кислота получается при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой или водных растворов хлорной кислоты с олеумом, а также при взаимодействии оксида хлора (VII) с водой: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + Н 2 O → 2 НCl. O 4
 Термическая устойчивость кислот – отношение к нагреванию Хлорная кислота (HCl. O 4) Ø Удается выделить в свободном виде; Ø При умеренном нагревании с фосфорным ангидридом разлагается § 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хлорноватая кислота (HCl. O 3) Ø При слабом нагревании разлагается § 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлористая кислота (HCl. O 2) Ø Очень неустойчива, разлагается при комнатной температуре на свету § 4 НСl. O 2 = НCl + НСl. O 3 + 2 Cl. O 2 + H 2 O Хлорноватистая кислота (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под действием света)
Термическая устойчивость кислот – отношение к нагреванию Хлорная кислота (HCl. O 4) Ø Удается выделить в свободном виде; Ø При умеренном нагревании с фосфорным ангидридом разлагается § 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хлорноватая кислота (HCl. O 3) Ø При слабом нагревании разлагается § 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлористая кислота (HCl. O 2) Ø Очень неустойчива, разлагается при комнатной температуре на свету § 4 НСl. O 2 = НCl + НСl. O 3 + 2 Cl. O 2 + H 2 O Хлорноватистая кислота (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под действием света)
 Отношение к растворам щелочей При взаимодействии кислородсодержащих кислот хлора с растворами щелочей по реакции обмена образуется соль этой кислоты и вода. Происходит реакция нейтрализации. HCl. O 2 + Na. OH = Na. Cl. O 2 + H 2 O; HCl. O 3 + KOH = KCl. O 3 + H 2 O; Отношение к основным оксидам При взаимодействии кислородсодержащих кислот хлора с основными оксидами по реакции обмена образуется соль этой кислоты и вода. 2 HCl. O + Na 2 O = 2 Na. Cl. O + H 2 O; 2 HCl. O 4 + Cu. O = Cu(Cl. O 4)2 + H 2 O
Отношение к растворам щелочей При взаимодействии кислородсодержащих кислот хлора с растворами щелочей по реакции обмена образуется соль этой кислоты и вода. Происходит реакция нейтрализации. HCl. O 2 + Na. OH = Na. Cl. O 2 + H 2 O; HCl. O 3 + KOH = KCl. O 3 + H 2 O; Отношение к основным оксидам При взаимодействии кислородсодержащих кислот хлора с основными оксидами по реакции обмена образуется соль этой кислоты и вода. 2 HCl. O + Na 2 O = 2 Na. Cl. O + H 2 O; 2 HCl. O 4 + Cu. O = Cu(Cl. O 4)2 + H 2 O
HClO – хлорноватистая кислота. Ей соответствует кислотный оксид Cl 2 O. Соли называются гипохлоритами.
HClO 2 – хлористая кислота. Кислотный оксид Cl 2 O 3 не получен. Соли – хлориты.
HClO 3 – хлорноватая кислота. Кислотный оксид Cl 2 O 5 не получен. Соли – хлораты.
HClO 4 – хлорная кислота. Кислотный оксид - Cl 2 O 7 . Соли – перхлораты.
1) HClO – желтоватая жидкость. Существует только в растворах. Получается при взаимодействии хлора с водой (без нагревания):
Cl 2 + H 2 O = HCl + HClO
Соли этой кислоты получаются при действии на щелочь хлора:
2KOH + Cl 2 = KClO + KCl + H 2 O
используется как отбеливатель в текстильной промышленности.
2) HClO 2 , HClO 3 – не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в пиротехнике и взрывных работах. Наибольшее значение имеет KClO 3 – хлорат калия (бертолетовая соль), получаемая насыщением горячей щелочи хлором:
3Cl 2 + 6KOH = KClO 3 + 5KCl + 3H 2 O
Хлораты - сильнейшие окислители. При ударе или нагревании взрываются.
3) Известен оксид ClO 2 , который можно получить по реакции:
2KClO 3 + H 2 C 2 O 4 = K 2 CO 3 + CO 2 + H 2 O + 2ClO 2
ClO 2 – зелено-желтый газ, при растворении в воде дает смесь кислот:
2ClO 2 + H 2 O = HClO 2 + HClO 3
4) Осторожным нагреванием хлораты можно перевести в перхлораты, из которых можно получить хлорную кислоту:
KClO 4 + H 2 SO 4 = HClO 4 + KHSO 4
Хлорная кислота HClO 4 – подвижная жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти все ее соли хорошо растворимы в воде.
5) В ряду HClO - HClO 2 - HClO 3 - HClO 4 сила кислот растет, а окислительная способность падает.
Хлор находит широкое применение в химической промышленности для получения хлористого водорода и соляной кислоты, синтеза хлорорганических веществ, обеззараживания питьевой воды, в текстильной промышленности для отбеливания тканей, в производстве ядохимикатов.
Бром
Бром находится в виде калиевых и натриевых солей в воде морей. Производство основано на реакции:
2NaBr + Cl 2 = Br 2 + 2NaCl
Для этого раствор NaBr и органический растворитель (бензол или бензин) заливают в емкость и через смесь пропускают хлор. Бром переходит в органическую фазу, откуда затем отгоняется. Бром – жидкость темно-красного цвета, тяжелая, легколетучая, вызывает тяжелые ожоги.
Бром Br 2 химически менее активен, чем Cl 2 , однако вступает в те же реакции, что и хлор. Соли HBr носят название – бромиды.
Соль AgBr, используется в кино- и фотопромышленности как светочувствительный реактив. Соединения брома используются в медицине.
В природе встречается в виде KJ, NaJ в воде и морских водорослях. Водоросли сушатся, сжигаются и из золы извлекается иод по реакции:
2NaJ + Cl 2 = 2NaCl + J 2
Иод – твердое кристаллическое вещество, темно-фиолетового цвета, способное к сублимации или возгонке (переход из твердого состояния в газообразное при нагревании, минуя жидкую фазу).