Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь (например, мет-, эт-. пpo п-, бут-, пент-, гекс- и т.д.). Затем следует суффикс, характеризующий степень насыщенности, -ан, если в молекуле нет кратных связей, -ен при наличии двойных связей и -ни для тройных связей, например, пентан, пентен. Если кратных связей в молекуле несколько, то в суффиксе указывается число таких связей, например: -диен, -триен, а после суффикса обязательно арабскими цифрами указывается положение кратной связи (например, бутен-1, бутен-2, бутадиен-1,3):
СН 3 -СН 2 -СН=СН 2 СН 3 -СН=СН-СН 3 СН 2 =СН-СН=СН 2
бутен-1 бутен-2 бутадиен-1,3
Далее в суффикс выносится название самой старшей характеристической группы в молекуле с указанием ее положения цифрой. Прочие заместители обозначаются с помощью приставок. При этом они перечисляются не в порядке старшинства, а по алфавиту. Положение заместителя указывается цифрой перед приставкой, например: 3-метил; 2-хлор и т.п. Если в молекуле имеется несколько одинаковых заместителей, то перед названием соответствующей группы словом указывается их количество (например, диметил-, трихлор- и т.д.). Все цифры в названиях молекул отделяются от слов дефисом, а друг от друга запятыми. Углеводородные радикалы имеют свои названия.
Предельные углеводородные радикалы:
метил этил пропил изопропил
Бутил втор-бутил
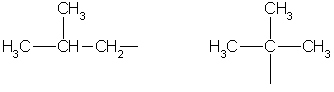
изобутил трет-бутил
Непредельные углеводородные радикалы:
СН 2 =СН- НС — С- СН 2 =СН-СН 2 —
винил этинил аллил
Ароматические углеводородные радикалы:

фенил бензол
В качестве примера назовем следующее соединение:

Выбор цепи однозначен, следовательно, корень слова — пент, далее следует суффикс -ен, указывающий на наличие кратной связи; порядок нумерации обеспечивает старшей группе (-ОН) наименьший номер; полное название соединения заканчивается суффиксом, обозначающим старшую группу (в данном случае суффикс –o л указывает на наличие гидроксильной группы); положение двойной связи и гидроксильной группы указывается цифрами.
Следовательно, приведенное соединение называется пентен-4-ол-2.
Тривиальная номенклатура представляет собой совокупность несистематических исторически сложившихся Названий органических соединений (например: ацетон, уксусная кислота, формальдегид и т.д.). Важнейшие тривиальные названия вводятся в тексте при рассмотрении соответствующих классов соединений.
Рациональная номенклатура позволяет строить название вещества на основании его структуры с более простым соединением, выбранным в качестве прототипа. Способ такого построения иллюстрируют следующие примеры:
триметилметан ацетилацетон фенилуксусная кислота
Международный союз по теоретической и прикладной химии сформулировал общие правила для формирования названий химических соединений – так называемую систематическую международную номенклатуру . Она является наиболее строгой, достаточно простой и универсальной; название неорганических соединений строится по следующим основным правилам:
Если соединение состоит только из двух элементов, то первый называют по-русски (на национальном языке страны), указывая приставками (ди, три, тетра и т.д.) число его атомов. Второй элемент называют по латыни с суффиксом -ид (и соответствующими количественными приставками): например: NaCl - натрий хлорид, BaO - барий оксид, BN –бор нитрид, GaAs – галлий арсенид, N 2 O –диазот оксид, СеO 2 - церий диоксид, S 2 O 3 - дисера триоксид;
Если соединение состоит из трех и более элементов (например, кислородсодержащие кислоты, основания, соли), то кислотный остаток называют слитно справа налево, указывая количество атомов кислорода – оксо, диоксо, триоксо и т.д., а затем по латыни элемент с суффиксом -ат (в скобках записывают римскими цифрами его степень окисления (при условии, что данный элемент имеет несколько с. о. в соединениях). В конце названия пишут через дефис слово «ион». Например:
SO 4 2- - тетраоксосульфат (VI) - ион
SO 3 2- - триоксосульфат (IV) – ион
NO 3 - - триоксонитрат (V) – ион
NO 2 - - диоксонитрат (III) – ион
SiO 3 2- - триоксосиликат (IV) – ион (метасиликат-ион по полусистематической номенклатуре, использование которой допустимо). Например:
Na 2 SiO 3 - динатрий триоксосиликат (IV) или динатрий метасиликат
PO 4 3- -тетраоксофосфат(V) (или ортофосфат-ион по полусистематической номенклатуре).
АlPO 4 – алюминий тетраоксофосфат(V) , или алюминий ортофосфат
СО 3 2- - триоксокарбонат-ион (карбонат- ион)
СaCO 3 кальций триоксокарбонат, кальций карбонат
РО 3 - –триоксофосфат (V) - ион или метафосфосфат- ион
Zn(PO 3) 2 – цинк триоксофосфат(V) или цинк метафосфат
OH - – гидроксид- ион
Сa(OH) 2 –кальций дигидроксид
В настоящее время в России наиболее широко распространена международная или полусистематическая номенклатура (рассмотренную выше систематическую номенклатуру в школьной программе до сих пор практически не изучают). В технической, технологической, научной литературе, во многих ГОСТах, документации часто встречается русская номенклатура , которая формально давно отменена. Кроме того, нередко на этикетках, в справочной литературе, в технологических инструкциях и т.д. встречаются названия соединений по тривиальной номенклатуре . В качестве примера далее в тексте приведена таблица с названиями некоторых неорганических соединений по различным разновидностям химической номенклатуры, которые используются или встречаются в настоящее время в России.
| Формула соединения | Химическая номенклатура | |||
| систематическая | полусистематическая | русская | тривиальная | |
| N 2 O | диазот оксид | оксид N(I) | полуокись азота закись азота | веселящий газ |
| NO 2 | оксид диазот | оксид N(IV), диоксид азота | двуокись азота | «лисий» хвост |
| HNO 3 | водород триоксонитрат (V) | кислота азотная | азотная кислота | – |
| HCl | водород хлорид | хлорид водорода | хлороводородная кислота | соляная кислота |
| H 2 SO 4 | диводород тетраоксосульфат (VI) | кислота серная | серная кислота | купоросное масло |
| NaOH | натрий гидроксид | гидроксид натрия | гидроокись натрия | едкий натр |
| Ca(OH) 2 | кальций дигидроксид | гидроксид кальция | гидроокись кальция | известковая вода, гашеная известь |
| NaHS | натрий водородсульфид | гидросульфид натрия | кислый сернистый натрий | – |
| ZnOHCl | цинк гидроксид хлорид | хлорид гидроксоцинка | основной хлористый цинк | – |
| CaHPO 4 | кальций водород тетраоксофосфат(V) | гидрофосфат кальция | кислый двузамещенный ортофосфорнокислый кальций | – |
| PH 3 | фосфор тригидрид | гидрид фосфора (III) | водородистый фосфор | фосфин |
| АlOHSO 3 | алюминий гидроксид триоксо- сульфат(IV) | сульфит гидроксо- алюминия | основной двузамещенный сернистокислый алюминий | – |
| Na 2 CO 3 | динатрий триоксокарбонат (IV) | карбонат натрия | углекислый натрий | сода |
| KNO 3 | калий триоксонитрат (V), калия нитрат | нитрат калия | азотнокислый калий | селитра (калиевая) |
Абитуриентам, поступившим в высшие учебные заведения необходимо также знать групповые названия элементов:
Щелочные металлы: Li, Na, K, Rb, Cs, Fr;
Щелочноземельные металлы: Ca, Sr, Ba, Ra;
Переходные элементы 3d-ряда (3d-элементы): Sc……Zn;
Лантаноиды (редкоземельные элементы): Сe ……Lu;
Актиноиды (трансурановые элементы): Th………Lr;
Платиноиды (элементы группы платины): Ru, Rh, Pd, Os, Ir, Pt;
Халькогены: S, Se, Te;
Галогены: F, Cl, Br, I, At.
Эти названия часто используются для выделения различных типов соединений, например: сульфиды щелочных металлов, галогениды переходных элементов и т.п.
Классификация неорганических соединений
Большинство неорганических соединений могут быть разделены на три основных класса (типа): оксиды, гидроксиды и соли. Для лучшего понимания бескислородные кислоты можно условно выделить в отдельний класс неорганических соединений. Общая схема классификации представлена на рис 1 (см. приложение 1). Эта классификация не является полной, так как в нее не вошли некоторые менее часто встречающиеся бинарные (то есть состоящие из двух элементов) соединения (например, арсин – AsH 3 , сероуглерод –CS 2 и пр.).
Оксиды
Химические соединения элементов с кислородом вида называются оксидами (степень окисления атома О в оксидах равна «-2»).
Систематическая номенклатура оксидов : на первом месте указывают название элемента в именительном падеже с соответствующими греческими количественными приставками, далее - слово «оксид» также с соответствующими количественными приставками, например: SiO 2 - кремний диоксид, Fe 2 O 3 - дижелезо триоксид, P 2 O 5 - дифосфор пентоксид и т.д..
Полусистематическая (международная) номенклатура : на первом месте находится слово «оксид», за которым следует название элемента в родительном падеже с указанием римскими цифрами в скобках его степени окисления, например:
Fe 2 O 3 – оксид железа (III), допускается запись: оксид Fe (III);
FeO- оксид железа (II), допускается запись: оксид Fe(II);
P 2 O 3 - оксид фосфора (III);
P 2 O 5 - оксид фосфора (V);
NO – оксид азота (II), допускается запись монооксид азота;
NO 2 – оксид азота (IV), допускается запись диоксид азота.
Na 2 O – оксид натрия (натрий имеет только одно значение степени окисления в соединениях, в таких случаях ее не указывают).
Русская номенклатура в названиях оксидов оперирует словом «окись» с указанием количества атомов кислорода на один атом элемента, например: N 2 O – полуокись азота,
Fe 2 O 3 – полутороокись железа,
CO 2 – двуокись углерода.
Следует отметить, что в русской номенклатуре оксид элемента с низшей степенью окисления часто называли закисью элемента, а оксид того же элемента с высшей степенью окисления – окисью, например: Сu 2 О - закись меди, CuO- окись меди.
Существуют соединения элементов с кислородом, которые не проявляют свойств оксидов (в этих соединениях атом кислорода имеет степень окисления, которая не равна «-2»). Например, Н 2 О 2 -1 - пероксид водорода (перекись водорода), проявляет свойства слабой кислоты, Na 2 O 2 -1 - пероксид натрия – соль. В этих соединениях содержится группы атомов –О–О– или анион . Схема классификации оксидов приведена на рис. 2 (см. приложение 2).
Гидроксиды
Гидроксиды - это сложные вещества общей формулы , то есть продукты прямого или косвенного взаимодействия оксидов с водой. Гидроксиды по своему характеру могут быть разделены на 3 группы: основные (основания), кислотные (кислородсодержащие кислоты) и амфотерные основания (см. рис. 1 приложения).
Основания
Общая формула (n<= 4), где Me - атом металла в степени окисления +n. Исключение – гидроксид аммония NH 4 OH, не содержащий атомов металла.Основания - это соединения, при диссоциации которых в водных растворах образуется только один вид анионов (отрицательно заряженные ионы) – гидроксид-ионы ОН - (более широкое определение: основания – это соединения, присоединяющие протон (Н +) или являющиеся акцепторами протонов Н +).
Растворимыми в воде основаниями или щелочами являются гидроксиды наиболее активных металлов (щелочных и щелочноземельных): LiOH, KOH, NaOH, RbOH, CsOH; Sr(OH) 2 , Ba(OH) 2 . Перечисленные основания являются сильными электролитами (степень диссоциации α → 1). Все остальные гидроксиды металлов являются малорастворимыми или практически нерастворимыми и одновременно слабыми электролитами. Следует запомнить, что растворимое в воде основание NH 4 OH (раствор газообразного аммиака NH 3 в воде) является слабым. Основания AgOH и Hg(OH) 2 самопроизвольно разлагаются в растворах на оксид и воду.
По количеству гидроксид-ионов или –ОН групп все основания можно разделить на однокислотные (содержат одну –ОН группу) и многокислотные (содержат более одной –ОН группы). Следует знать, что гидроксид-ионы ОН - образуются и существуют только в растворах при диссоциации оснований, а также основных солей.
В названии основания по систематической международной номенклатуре на первое место ставят название элемента, образующего основание, за которым следует слово « гидроксид», с соответствующей количественной приставкой, при необходимости, например:
Mg(OH) 2 – магний дигидроксид,
Cr(OH) 3 – хром тригидроксид
NaOH – натрий гидроксид
Полусистематическая (международная) номенклатура: на первое место ставится слово « гидроксид», за которым следует название элемента в соответствующем падеже и указание степени окисления элемента (римскими цифрами в круглых скобках), например, NaOH – гидроксид натрия, Cr(OH) 3 - гидроксид хрома(III). Устаревшая русская номенклатура оперирует словом «гидроокись» с соответствующими количественными приставками, указывающими количество гидроксид-ионов в основании – NaOH – гидроокись натрия (название по тривиальной номенклатуре и старое техническое название – едкий натр).
Кислородсодержащие кислоты
Кислородсодержашие кислоты также относятся к гидроксидам . Это электролиты, образующие при диссоциации в водных растворах из положительно заряженных ионов только ионы водорода H + , или, более точно, ионы гидроксония Н 3 О + - гидратированный ион водорода. Более общее определение: кислоты – это вещества, являющиеся донорами протонов Н + . В зависимости от количества катионов водорода, образующихся при диссоциации кислоты, кислоты классифицируют также как основания, по основности. Существуют одно-, двух-, трех- и четырехосновные кислоты. Например, азотная кислота HNO 3 , азотистая кислота HNO 2 –одноосновные кислоты, угольная кислота H 2 CO 3 , серная кислота H 2 SO 4 – двухосновные кислоты, ортофосфорная кислота H 3 PO 4 является трехосновной кислотой, а ортокремниевая кислота H 4 SiO 4 –четырехосновной кислотой.
Номенклатура кислородсодержащих кислот : по названия кислородсодержащих кислот формируются, как указывалось ранее, с учетом аниона, входящего в состав кислоты. Например:
H 3 PO 4 - триводород тетраоксофосфат(V) или триводород ортофосфат
H 2 CO 3 - диводород триоксокарбонат (IV)
HNO 3 - водород триоксонитрат (V)
Н 2 SiO 3 - диводород триоксосиликат (IV) или диводород метасиликат
H 2 SO 4 - диводород тетраоксосульфат(VI) (количество атомов водорода в кислотах можно не указывать)
По систематической номенклатуре названия кислот используют редко, чаще всего применяют традиционно сложившиеся названия, которые формируются от русского названия элемента (русская номенклатура) по определенным правилам (см. таблицу). В таблице приведен перечень кислородсодержащих кислот, соли которых наиболее распространены в природе. Следует обратить внимание, что название кислотного остатка определяет название соли и строят его чаще всего по полусистематической (международной) номенклатуре от латинского названия элемента. В связи с этим необходимо вспомнить латинские названия элементов наиболее часто встречающихся в кислотах, например, N – азот, в русской транскрипции латинского названия звучит как [нитрогениум], С – углерод – [карбониум], S – сера – [сульфур], Si- кремний – [силициум], олово – [станнум], свинец – [плюмбум], мышьяк – [арсеникум] и т.д. В таблице приведены общие правила, в соответствии с которыми можно назвать большинство неорганических кислородсодержащих кислот других элементов, их кислотные остатки и соли.
Таблица наиболее распространенных кислородсодержащих кислот
| Формула кислоты | Название кислоты по русской номенклатуре | Кислотный остаток | Название кислотного остатка и соли |
| серная | SO 4 2- HSO 4 - | сульфат-ион, сульфаты, гидросульфат-ион, гидросульфаты | |
| +4 H 2 SO 3 | cернистая | SO 3 2- HSO 4 - | cульфит-ион, сульфиты, гидросульфит-ион, гидросульфиты |
| +5 HNO 3 | азотная | NO 3 - | нитрат-ион; нитраты |
| +3 HNO 2 | азотистая | NO 2 - | нитрит-ион, нитриты |
| +5 HPO 3 | метафосфорная | PO 3 - | метафосфат-ион, метафосфаты |
| +5 H 3 PO 4 | ортофосфорная | PO 4 3- H 2 PO 4 - HPO 4 2 | ортофосфат-ион, ортофосфаты, дигидро(орто)фосфат-ион, дигидро(орто)фосфаты, гидро(орто)фосфат-ион, гидро(орто)фосфаты |
| +5 H 4 P 2 O 7 | двуфосфорная (пирофосфорная) | P 2 O 7 4- | пирофосфат-ион, пирофосфаты |
| +3 HPO 2 | фосфористая | PO 2 - | фосфит-ион, фосфиты |
| H 2 CO 3 | угольная | CO 3 2- HCO 3 - | карбонат-ион, карбонаты, гидрокарбонат-ион, гидрокарбонаты |
| H 2 SiO 3 | метакремниевая | SiO 3 2- HSiO 3 - | метасиликат-ион, метасиликаты, гидрометасиликат-ион, гидрометасикаты |
| H 4 SiO 4 | ортокремниевая | SiO 4 4- H 3 SiO 4 - H 2 SiO 4 2- HSiO 4 3- | ортосиликат-ион; ортосиликаты, тригидро(орто)силикат-ион, тригидро(орто)силикаты, дигидро(орто)силикат-ион дигидро(орто)силикаты, гидроортосиликат-ион, гидроортосиликаты |
| H 2 CrO 4 | хромовая | CrO 4 - | хромат-ион, хроматы |
| H 2 Cr 2 O 7 | двухромовая | Cr 2 O 7 2- | бихромат-ион, бихроматы |
| HClО | хлорноватистая | ClO - | гипохлорит-ион, гипохлориты |
| HClO 2 | хлористая | ClO 2 - | хлорит-ион, хлориты |
| HClO 3 | хлорноватая | ClO 3 - | хлорат-ион, хлораты |
| HClO 4 | хлорная | ClO 4 - | перхлорат-ион, перхлораты |
Гидросоли и названия их кислотных остатков будут рассмотрены в разделе«соли». Правила названия кислородсодержащих кислот и кислотных остатков (за исключением тех, которые имеют тривиальные названия или их следует называть по систематической номенклатуре) следующие:
Высшая с. о. элемента (равна № группы в периодической системе) – корень русского названия элемента + окончание «а я» или «ова я»
Название
Кислородсодержащей
Кислоты
С.о. элемента < max – корень русского названия элемента +
окончание «и стая» или «ови стая»
Высшая с.о. элемента – корень латинского названия элемента +
Название суффикс «а т»
Кислотного
остатка
с.о. элемента < max – латинское название элемента + суффикс «и т»
Зная приведенные правила, легко вывести формулы кислот для различных элементов (с учетом положения в периодической системе) и назвать их. Например, металл Sn - олово (1V гр.) латинское название - stannum («станнум»):
Max с.о. = +4 Min с.о. = +2
Оксиды: SnO 2 SnO
амфот. амфот.
+Н 2 О+Н 2 О
Н 2 SnO 3 H 2 SnO 2
оловянная кислота оловянистая кислота
SnO 3 2- SnO 2 2-
станнат - ион, станнит -ион,
Na 2 SnO 3 – станнат Na Na 2 SnO 2 – станнит Na
Оксидам некоторых элементов соответствуют две кислоты: мета - и ортокислота , формально они отличаются на одну молекулу Н 2 О.
Вывод формулы мета и ортокислоты (если они существуют у данного элемента): при формальном присоединении к оксиду одной молекулы Н 2 О получаем формулу метакислоты, последующее присоединение еще одной молекулы воды к формуле метакислоты позволяет вывести формулу ортокислоты. Например, выведем формулу мета- и ортокислоты, соответствующей оксиду P (V):
+H 2 O +H 2 O
H 2 P 2 O 6 à HPO 3 - метафосфорная к-та H 3 PO 4 - ортофосфорная к-та
Приведем пример обратной задачи: назвать соли NaBO 2 и K 3 BO 3 . Степень окисления атома бора в этих солях равна +3 (проверьте расчет), следовательно, соли образованы от кислотного оксида В 2 О 3 . Если в обеих солях степени окисления бора одинаковые, а виды кислотных остатков разные, то это соли мета- и ортоборной кислоты. Выведем формулы этих кислот:
В 2 О 3 НВО 2
+ Н 2 О + Н 2 О
НВО 2 - метаборная кислота, Н 3 ВО 3 - ортоборная кислота,
соли – метабораты соли – ортобораты
Названия солей: NaBO 2 – метаборат натрия; Na 3 BO 3 - ортоборат натрия.
Бескислородные килоты
Общая формула таких кислот H х Э у. Эта группа соединений по химическим свойствам и характеру диссоциации в водных средах (образование ионов гидроксония Н 3 О +) сходна с кислородсодержащими кислотами, однако может быть выделена в отдельную группу, т.к. они не являются гидроксидами. Аналогично кислородным кислотам, они могут быть различной основности.
Название по систематической номенклатуре формируют следующим образом: на первом месте стоит слово «водород» с соответствующими количественными приставками, затем следует латинское название элемента с суффиксом «ид», например:
HCl- водород хлорид
H 2 S – диводород сульфид
HCNS - водород роданид
Наиболее распространенные бескислородные кислоты, название по полусистематической (международной) номенклатуре их кислотных остатков и солей приведены ниже:
Название бескислородной кислоты : сочетание корня русского названия элемента и слова «водородная». (По полусистематической номенклатуре на первом месте - название кислотного остатка + слово «водорода», например HCl-хлорид водорода, H 2 S- сульфид водорода, в современной русской учебной литературе наиболее распространены названия, которые приведены в таблице).
Название кислотного остатка : корень латинского названия элемента с суффиксом «и д».
Как и основания, все кислоты, независимо от их состава являются электролитами разной силы и подразделяют в зависимости от степени диссоциации на сильные , слабые кислоты и кислоты средней силы .
Следует запомнить, что сильными кислотами являются следующие: H 2 SO 4 , HCl, HBr, HI, HNO 3 , HClO 4 , HMnO 4 .
Такие кислоты, как H 2 CO 3 , H 2 S, H 2 SiO 3 , HNO 2 , H 3 BO 3 , HСlO, HCN являются слабыми кислотами .
Соли
Соли – сложные вещества, состоящие из катионов (положительно заряженных частиц, чаще всего атомы металла) и отрицательно заряженных кислотных остатков. Разделяют по видам на нормальные (средние), гидросоли (кислые соли), гидроксосоли (основные соли), двойные соли, смешанные и комплексные . Двойные соли содержат атомы двух металлов и общий кислотный остаток, например, алюмокалиевые квасцы - KAl (SO 4) 2 ·12H 2 O. Смешанные соли имеют в своем составе разные кислотные остатки, например CaOCl 2 - смешанная соль кислот HCl и HСlO. В составе комплексных солей присутствует комплексный катион, например, Cl, или комплексный анион – Na. Как правило, вне зависимости от растворимости, большинство солей являются сильными электролитами.
Нормальные (средние) соли
Нормальные, или средние соли представляют собой продукт полной нейтрализации кислоты основанием (полное замещение атомов водорода атомами металла (более строго - катионами оснований) или полное замещение гидроксид-ионов основания кислотными остатками. В растворах диссоциируют с образованием катионов и анионов (кислотных остатков).
По международной систематической номенклатуре названия солей формируются аналогично описанным ранее названиям других классов соединений.. Например, Na 2 CO 3 - динатрий триоксокарбонат, К 2 SO 4 - дикалий тетраоксосульфат(VI), СaSiO 3 - кальций триоксосиликат (IV), NaClO – натрий хлорат (I), NaClO 2 –натрий хлорат (II), NaCl- натрий хлорид, Na 2 S- динатрий сульфид и т.д.
По полусистематической (международной) номенклатуре на первое место ставят название кислотного остатка (см. таблицы кислот), на второе – название катиона соли с указанием римскими цифрами без алгебраического знака степени окисления металла, если это, как отмечали ранее, необходимо. Например, Na 2 CO 3 – карбонат натрия, NaClO – хлорит натрия, FeSO 4 - сульфат железа (II), Fe 2 (SO 4) 3 –сульфат железа (III), Na 2 S – сульфид натрия. Допускается запись: FeSO 4 – сульфат Fe(II), Fe 2 (SO 4) 3 – сульфат Fe(III). В редких случаях для высших степеней окисления элемента в кислотном остатке используется приставка «пер » или «пиро » с суффиксом – «ат» , а в низшей степени окисления в названии соли приставка «гипо» с суффиксом «ит ». Например, NaClO можно назвать гипохлоритом натрия, NaClO 4 - перхлоратом натрия, а знаменитую «красную ртуть» Hg 2 Sb 2 O 7 - пиростибатом ртути, без указания степени окисления элемента в кислотном остатке.
По русской номенклатуре, считающейся в настоящее время устаревшей, названия нормальных солей образуют от названия соответствующей кислоты с прибавлением слова «кислый » (для солей, образованных от кислородсодержащих кислот) и названия катиона (при различных степенях окисления металла используют слова «окисное » или «закисное »), например:
Na 2 SO 4 - серно кислый натрий (высшая степень окисления у атома серы)
Na 2 SO 3 - сернисто кислый натрий (степень окисления у атома серы меньше максимальной).
Fe(NO 3) 2 – азотнокислое закисное железо
Fe(NO 2) 3 – азотистокислое окисное железо
Названия нормальных солей бескислородных кислот по русской номенклатуре начинают с кислотного остатка (русское название элемента в нем записывают в виде прилагательного с суффиксом «ист ») и заканчивают названием катиона: Na 2 S - сернистый натрий, КСN - цианистый калий. Если катион (атом металла) проявляет несколько степеней окисления, то в солях с высшей степенью окисления атома металла название кислотного остатка имеет окончание «ая , ое » (CuCl 2 – хлорная медь, FeCl 3 – хлорное железо). При более низкой степени окисления атома металла окончание кислотного остатка будет «истая, истое » (CuCl – хлористая медь, FeCl 2 – хлористое железо).
Названия нормальных солей по русской номенклатуре достаточно сложны, и менее универсальны, поэтому встречаются только в старой литературе . Тем не менее, мы сочли необходимым дать их, поскольку они пока еще используются в технической литературе, некоторых справочниках, на этикетках химреактивов и др.
Примеры названий некоторых солей по полусистематической и систематической номенклатуре приведены ниже:
| Формула соли | Название по полусистематической номенклатуре | Название по систематичекой номенклатуре |
| Na 2 CO 3 | карбонат натрия | динатрий триоксокарбонат |
| Ca 2 SiO 4 | метасиликат кальция | дикальций тетраоксосиликат |
| NaCrO 2 | метахромит натрия | натрий диоксохромат (III) |
| Na 3 CrO 3 | ортохромит натрия | тринатрий триоксохромат (III) |
| К 2 CrO 4 | хромат калия | дикалий тетраоксохромат (VI) |
| КClO 4 | перхлорат калия | калий тетраоксохлорат (VII) |
| Ва(ClO 3) 2 | хлорат бария | барий триоксохлорат (V) |
| КClO 2 | хлорит калия | калий диоксохлорат (III) |
| Са(ClO) 2 | гипохлорит калия | кальций оксохлорат (I) |
| CuS | сульфид меди (II) | медь сульфид |
| Cu 2 S | сульфид меди (I) | димедь сульфид |
Основные способы получения нормальных, гидро- и гидроксосолей
Напомним, что условием протекания реакции в растворе электролита до конца является: а) образование плохо растворимого вещества; б) газа; в) слабого электролита; г) устойчивого комплексного аниона или катиона. Гидросоли и гидроксосоли, как правило, можно получить теми же способами, которые используют для получения нормальных солей, но при другом соотношении исходных веществ. Основные способы их получения приведены в этом разделе:
1. Реакция нейтрализации (в зависимости от соотношения основания и кислоты можно получить разные виды солей):
Fe(OH) 2 + H 2 SO 4 = FeSO 4 + 2 H 2 O
Fe(OH) 2 + 2 H 2 SO 4 = Fe(HSO 4) 2 + 2 H 2 O
2 Fe(OH) 2 + H 2 SO 4 = (FeOH) 2 SO 4 + 2 H 2 O
(FeOH) 2 SO 4 + H 2 SO 4 = 2 FeSO 4 + 2 H 2 O
2. Взаимодействие металлов с кислотами, неметаллами и солями :
Ca + H 2 SO 4 p = CaSO 4 + H 2
4 Ca + 5 H 2 SO 4 к = 4 CaSO 4 + H 2 S + 4 H 2 O
Pb + H 2 SO 4 p = PbSO 4 ¯ + H 2
PbSO 4 ¯ + H 2 SO 4 = Pb(HSO 4) 2
2 Fe + 3 Cl 2 = 2 FeCl 3
CuSO 4 + Zn = Cu + ZnSO 4
3. Реакции с участием оксидов :
CaO + CO 2 = CaCO 3
Fe 2 O 3 + 3 H 2 SO 4 = Fe 2 (SO 4) 3 + 3 H 2 O
SO 3 + 2 Ca(OH) 2 = (CaOH) 2 SO 4 + H 2 O
SO 3 + Ca(OH) 2 = CaSO 4 + H 2 O
2 SO 3 + Ca(OH) 2 = Ca(HSO 4) 2
4. Реакции с участием солей (реакции обмена) :
Na 2 SO 4 + BaCl 2 = 2NaCl + BaSO 4 ¯
CuSO 4 + 2NaOH = Cu(OH) 2 ¯ + Na 2 SO 4
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
Ca(HSO 4) 2 + Na 2 CO 3 = CaCO 3 ¯ + 2 NaHSO 4
Таким образом, нормальные, гидросоли и гидроксосоли получают многими способами. При этом, использование одинаковых исходных веществ при различном их соотношении (п.1,3) позволяет получить разные соли. Достаточно много ошибок допускают при составлении названий солей. Номенклатура нормальных солей была рассмотрена выше. Однако обязательным условием составления правильных названий различных солей по полусистематической (международной) номенклатуре (наиболее широко используемой в русской учебной, научной и технической литературе) и написания их формул является хорошее знание номенклатуры кислот и кислотных остатков (см. таблицы кислот выше).
Гидросоли (кислые соли)
Гидросоли представляют собой продукты неполного замещения катионов водорода в кислоте.Эти соли содержат в составе кислотного остатка один или несколько атомов водорода: Сa(HSO 4) 2 , KH 2 PO 4 и др.Такого вида анионы можно обнаружить в водном растворе соли:
Ca(HSO 4) 2 Û Ca 2+ + 2 HSO 4 -
Приведем примеры названий гидросолей по международной систематической номенклатуре :
NaHCO 3 - натрий водородтриоксокарбонат
NaH 2 PO 4 - натрий диводородтетраоксофосфат (V)
Na 2 HPO 4 - динатрий водородтетраоксофосфат (V)
NaHSO 4 - натрий водородтетраоксосульфат (VI)
По русской номенклатуре названия кислых солей образуют из названий нормальных солей с добавлением слова «кислый ». Если кислая соль образована от трех- и четырехосновных кислот, то необходимо также указывать количество замещенных атомов водорода, например:
NaHCO 3 - кислый углекислый натрий
NaH 2 PO 4 - кислый однозамещенный фосфорнокислый натрий
Na 2 HPO 4 - кислый двузамещенный фосфорнокислый натрий
Некоторые названия органических веществ, например, спирт и эфир, пришли к нам еще от алхимиков, очень многие вещества получили свои имена в девятнадцатом веке. Одни названия прямо указывают, из чего было впервые выделено данное вещество: винный спирт, гераниол, яблочная, щавелевая, муравьиная кислоты и т.д. Другие - отражают способ получения вещества: серный эфир, имя открывшего их ученого и т.п.
В настоящее время общепринятой считается номенклатура, разработанная союзом ИЮПАК, хотя до сих пор широко применяются как тривиальные названия (уксусная кислота, мочевина), так и названия, составленные по принципам устаревших номенклатур (изооктан, тетраметилэтилен и т.п.)
· Номенклатура ИЮПАК составлена по заместительному принципу. Считается, что структурная формула состоит из основной цепи - атомов углерода, соединенных между собой в неразветвленную цепочку - и присоединенных к ним заместителей. Заместитель - это любой атом или группа атомов, которые замещают атом водорода в неразветвленной структуре основой цепи.
· Функциональные группы, которые непосредственно связаны с основной цепью или входят в ее состав, в номенклатуре ИЮПАК называют характеристическими группами .
· Название в номенклатуре ИЮПАК состоит из корня, который обозначает длину основной цепи, а также приставок и суффиксов, отражающих наличие и расположение заместителей, кратных связей и функциональных групп.
· Название может содержать все блоки, а может - только два: корень и суффикс кратности связей.
· Корень названия вещества происходит из названий неразветвленных алканов с аналогичной длиной цепи.
Рис. 1. Принципы названий по номенклатуре ИЮПАК
Чтобы составить название вещества, необходимо знать названия неразветвленных алканов. Табл. 1.

Первые четыре названия: метан, этан, пропан и бутан возникли исторически, а остальные происходят от греческих корней, обозначающих число атомов углерода в молекуле.
Все названия неразветвленных алканов состоят из корня и суффикса кратности связи -ан . Этот суффикс обозначает то, что вещество предельно - не содержит двойных и тройных связей.
Двойную связь обозначает суффикс -ен , тройную - -ин .
Неразветвленную цепь можно выбрать разными способами. Для того, чтобы название было однозначным, в номенклатуре существует алгоритм выбора основной цепи.
1. В основную цепь входит «старшая» характеристическая группа.
2. В основную цепь максимально включены характеристические группы и кратные связи.
3. Основная цепь максимально длинная из всех возможных.
4. Основная цепь - самая разветвленная.
Например, в основную цепь необходимо включить кратные связи (правила 2), даже, если она при этом не будет самой длинной (правило 3).
В таблице 2 приведены примеры названий характеристических групп. Стрелочка справа показывает увеличение старшинства: в данной таблице, чем выше группа, тем она «старше». Название старшей характеристической группы определяет суффикс названия вещества. Остальные характеристические группы при этом обозначаются приставками, наравне с прочими заместителями.

Таб. 2. Названия характеристических групп
1. В структурной формуле выбирают основную цепь, используя алгоритм выбора основной цепи.
2. Основную цепь нумеруют так, чтобы старшая характеристическая группа получила наименьший номер. Если такая группа отсутствует, наименьший номер получает кратная связь, причем, принято, что двойная связь старше тройной. В случае отсутствия кратных связей нумерацию проводят так, чтобы заместители получили наименьшие номера.
3. Перечисляют заместители с их номерами в алфавитном порядке, затем записывают корень названия, отвечающий числу атомов углерода в основной цепи, добавляют суффикс кратных связей и суффикс старшей характеристической группы.
4. Если в молекуле присутствует несколько одинаковых заместителей или кратных связей, то употребляют приставку, обозначающую их число (ди-, три-, тетра-, пента-, гекса- и т.д.). Числа в названиях отделяют дефисами, между числами ставят запятые.
В ходе урока вы смогли изучить тему «Основные принципы номенклатуры органических соединений». Вы узнали названия веществ по номенклатуре IUPAC, которой придерживаются во всем мире. Рассмотрели алгоритм выбора основной цепи, порядок составления названия органических соединений. Научились составлять названия органических соединений по структурной формуле.
источник видео - http://www.youtube.com/watch?t=1&v=DsF0Bx7FZKc
http://www.youtube.com/watch?t=11&v=z1UpyJY1U78
http://www.youtube.com/watch?t=110&v=HJnyF4Vfoy8
источник презентации - http://www.openclass.ru/node/222808
http://interneturok.ru/ru/school/chemistry/10-klass = конспект
3. Номенклатура органических соединений
Номенклатура в химии – это, образно говоря, профессиональный язык химиков. Она, в идеале, точно и ясно должна отображать химическое строение, пространственную структуру веществ и их химические превращения.
Органические вещества многообразны и многочисленны. Однако каждое соединение должно иметь своё название, а названию соединения должно соответствовать лишь одна структурная формула . Ещё в последней четверти XIX в. органические вещества в основном называли по тривиальной (эмпирической) номенклатуре, позже стали использовать рациональные названия. Однако рациональная номенклатура не является официальной и современная научная номенклатура не рекомендует её применять. Поэтому в саамы современных учебниках рациональные названия сохранились лишь для узкого ряда соединений, например алкил - и диалкилацетилены.
В 1919 г. С целью стандартизации химической номенклатуры, химических терминов, атомных масс, способов проведения эксперимента и предоставления полученных результатов был организован Международный союз по теоретической и прикладной химии – ИЮПАК (от англ. International Union of Pure and Appied Chemistry – IUPAC )
После съезда ИЮПАК в Лондоне, который состоялся в 1947 г., большая работа по расширению и исправлению правил была проведена комиссией ИЮПАК по номенклатуре органических соединений. Съезды ИЮПАК в 1957 и 1965 гг. рекомендовали разработанную ею номенклатуру к использованию, и она стала называться номенклатурой ИЮПАК. Правила этой номенклатуры выходили в разные годы отдельными изданиями, а в 1979 г. Были собраны в «Голубой книге», которая представляет собой наиболее полный свод современных правил номенклатуры органических соединений.
3.1 Тривиальная, или эмпирическая номенклатура
Тривиальные, или эмпирические, названия веществ – это случайные названия. Обычно они отражают природный источник, метод получения или какое-нибудь свойство соединения. Например, мочевина содержится в моче, муравьиная кислота – в выделениях муравьёв, щавелевая кислота – в щавеле, молочная кислота – в кислом молоке, яблочная кислота - в яблоке, лимонная кислота - в лимоне, виноградная кислота – в винограде; пировиноградную кислоту и пирогаллол получают пиролизом виноградной и галловой кислот; глицерин, гликоли, глицин или гликокол – вещества имеющие сладкий вкус.
H 2 NCONH 2 – мочевина,
HCOOH – муравьиная кислота,
НООССООН – щавелевая кислота,
СН3СН(ОН)СООН – молочная кислота,
НООССН(ОН)СН2СООН – яблочная кислота,

НОСН2СН(ОН)СН2ОН – глицерин,
НОСН2СН2ОН – этиленгликоль,
H 2 NCH 2 COOH – гликокол, глицин.
3.2 Рациональная номенклатура.
Прежде чем рассматривать основы этой номенклатуры, ознакомимся с несколькими важными в органической химии понятиями. Атомы углерода в цепи могут различаться по числу связей с соседними атомами углерода. Ели число таких связей четыре, то углерод называется четвертичным (четверт.), три – третичным (трет.), две – вторичным (втор.), одна – первичным (перв.).

При отрыве атома углерода от молекулы углеводорода образуется углеводородный радикал. Названия предельных ациклических радикалов получаются заменой суффикса -ан в названии углеводорода на –ил . Исходя из количества связей углерода со свободной валентностью с соседними атомами углерода различают первичные, вторичные, третичные радикалы. Неразветвлённый первичный радикал называют нормальным и обозначают строчной буквой н -, которая пишется через дефис перед общим названием радикала.

Вещества, близкие по строению и очень похожие по химическим свойствам, но различающиеся по молекулярному составу лишь на одну или несколько метиленовых групп CH 2 , называют гомологами. Гомологи образуют гомологический ряд, где каждый последующий гомолог отличается от предыдущего на одну метиленовую группу. Гомологические ряды углеводородов получили своё название от названий первых представителей – родоначальников ряда. Например, предельные углеводороды называются метановыми, а непредельные – этиленовыми или ацетиленовыми. По рациональной номенклатуре все гомологи рассматриваются как вещества, полученные заменой одного или нескольких атомов водорода в родоначальнике ряда на углеводородные радикалы. Поэтому сначала находят метановый углерод или этиленовый или ацетиленовый фрагмент и определяют радикалы, связанные с ними. В ациклическом предельном углеводороде за метановый углерод принимаю прежде всего четвертичный, в его отсутствие – третичный и т. д. сначала перечисляют углеводородные радикалы с множительными префиксами, а затем добавляют название родоначальника ряда.
СН3СН 2СН3 – диметилметан,
СН3С (СН3)2СН2СН(СН3)СН3 – триметилизобутилметан,
СН3СН2СН=СН 2 –этилэтилен,
СН3С≡СН – метилацетилен.
3.3 Научные номенклатуры
Номенклатура ИЮПАК органических соединений представляет собой систему нескольких научных номенклатур и способов названия. Для составления названия вещества в целом используют преимущественно заместительную номенклатуру ИЮПАК, реже – радикально-функциональную. Главная ациклическая цепь, содержащая несколько нетерминальных гетероатомов, гетероциклы могут быть названы по заменительной номенклатуре. В органической химии неуглеродный элемент, кроме водорода, называется гетероэлементом . Кислород, азот , сера, фосфор, кремний – гетероэлементы, наиболее часто встречающиеся в составе органических соединений. Если гетероатом находится в конце ациклической цепи, его называют терминальным , если он внутри этой цепи, то нетерминальным . Если в замкнутой цепи атомов, т. е. в цикле, имеется хотя бы один атом гетероэлемента, то такой цикл называют гетероциклом , а соединение – гетероциклическим .


Для гетероциклов разработан специальный способ названия расширенная система Ганча-Видмана , и названия гетероциклов по этой системе предпочтительны, чем названия по заменительной номенклатуре. Названия полиядерных карбоцилов, содержащих максимальное число некумулированных двойных связей, а также сложных систем, состоящих из карбо - и гетероцикла или нескольких гетероциклов, составляются по методу конденсирования .
3.3.1 Заместительная номенклатура
Заместительная номенклатура рассматривает любое органическое соединение как состоящее из родоночальной структуры и заместителей . Имеется также понятие характерных структурных элементов соединения , к которым относят заместители и типы связей или степень насыщенности. Степень насыщенности родоначальной структуры соединения и углеводородных радикалов передаётся суффиксами –ан (насыщенный, только одинарные связи), -ен (двойная связь), -ин (тройная связь). Если присутствует несколько одинаковых ненасыщенных связей, то используют множительные префиксы; ди-, три-, тетра- , и т. д.., например диен, диин, триен, триин.
Заместители делятся на углеводородные радикалы и характеристические группы. Последние в свою очередь формально разделяются на функциональные группы (ФГ) и нефункциональные группы (НФГ). Для ФГ имеется ряд старшинства:
RnN + H 3- n , COOH , SO 3 H , COOR , COHlg , CONH 2 , CN , CHO , > C = O , OH , SH , OOH , NH 2 .
Для НФГ и радикалов характерны только префиксные названия (в приведенном ниже примере 1: З-метил-5-хлоро-..; в примере 2: 5-бромо-...). Для ФГ характерны два названия: 1) для употребления в суффиксе (суффиксное обозначение или название), когда ФГ является старшей (в примере 3: ОН - старшая ФГ, суффиксное обозначение -ол; в примере 4: N Н2 - старшая ФГ, суффиксное название -амин); 2) для использования в префиксе (префиксное обозначение или название), когда ФГ является младшей (в приме ре 2: ОН - младшая ФГ, префиксное обозначение гидрокси-; в примере 1: N Н2 - младшая ФГ, префиксное название амино-).
Пример 1:
font-size:9.0pt;line-height:150%; font-family:Verdana">
Местоположения заместителей и ненасыщенных связей в родоначальной структуре указываются цифрами, которые получили н азвание локантов. Расположение локантов подчиняется простому правилу: локанты ставятся перед префиксами, но после суффик сов. Локанты отделяются друг от друга запятыми, а от префикса, суффикса и названия родоначальной структуры - черточками (см. примеры 1-4). Локанты конденсирования двух систем и более заключаются в квадратные скобки; они относятся к исходным компонентам (в примере 3 ), а не к конечной конденсированной системе. Цифры в квадратных скобках в названиях спира нов, бициклических и полициклических соединений не являются локантами, так как они указывают на число атомов в определенном звене (в примере 4 ), а не на их номера.
Если у одного и того же или у разных атомов родоначальной структуры имеется несколько одинаковых заместителей, то, соби рая их вместе, используют умножающие префиксы, например: 2,3,3-три метил-2,4-ди окси-, 2,3-ди оксо-1,5-ди хлоро-, .~ди а- мин-1,3, .-три ол- 1,3,4, .-ди карбоновая-1,4 кислота. Префиксные обозначения заместителей перечисляются в названии соединения в алфавитном порядке, но множительные префиксы не учитываются: СН3С(СН3)2СН(СН3)СН(С l )СН(С l )СООН -4,5,5-триметил-2,3-дихлорогексановая кислота.
В приведенных выше примерах 2-4 атомы углерода в циклах не изображены. Аналогичная запись формул используется также в ациклических системах. Например
Такую же форму записи можно применять и для обозначения углеводородных радикалов. В качестве примера приводятся алкилзамещенные бензолы:

В современной химической литературе углеводородные радиолы обозначаются двумя буквами их английских названий:
CH 3 – Me , C 2 H 5 – Et , н- C 3 H 7 – n - Pr , изо- C 3 H 7 – i - Pr , н- C 4 H 9 – n - Bu , втор.- C 4 H 9 – s - Bu , изо- C 4 H 9 – i - Bu , трет.- C 4 H 9 – t - Bu , C 6 H 5 – Ph , C 6 H 5 CH 2 – Bz .
Заместители бывают также простые (СН3, СН3(СН2)3СН2- , С6Н5, F , С l , J , N Н2, СN, ОН, NO , NO 2 ), составные, состоящие из двух или более простых, и сложные - из простого, с которым свя заны составные заместители. Как составные, так и сложные имеют единые префиксные названия, включая множительные приставки ди -, три - и т. д., причем их располагают в алфавитном порядке по первым буквам: д иметиламино-, м етиламино-, х лорометил, д ихлорометил, т рихлорометил, а минокарбонил-(СО N Н2), а лкоксикарбонил- (СОО R ), б ромокарбонил - (ВгСО), 3-г идрокси-2-(т рихлорометил)пропил [-СН2СН(СС l 3 )СН2ОН], 2-(д ихлорометил)-1-(трифторометил)-3,3,3-трихлоропропил [СС l 3 СН(СНС l 2 )СН(С F 3 )-]. Для составных и сложных заместителей, название которых, как правило, заключаются в скобки, используются умножающие префиксы бис-, трис-, тетракис- и т. д., которые при перечислении префиксов в алфавитном порядке не учитываются.

4-(д иметиламино)-2,3,5-трим етил-2,3-бис(т рифторометил)гексановая кислота.
Согласно правилам заместительной номенклатуры, название органического соединения состоит из названия родоначальной структуры, префиксов и суффиксов с соответствующими локантами.
Название соединения |
||
Перфиксы радикалов, младших ФГ, НФГ, гидро, т. е. определяемые префиксы в алфавитном порядке с локантами впереди | Название родоначальной структуры = неотделяемые префиксы + корень + суффикс степени насыщенности | Суффикс старшей ФГ |
Префиксы, которые являются интегральной частью названия родоначальной структуры, например цикло - (примеры 2, 4), изо-, а-обозначения элементов (окса-, тиа~, аза-, фосфа-, и т. д., см. пример 4, окса-), название причлененнои структуры по методу конденсирования (бензо-, нафто-, антра-, тиено-, пирано - и т. д., см. пример 3, имидазо-), а также эпокси - и эпитио-, указывающие на присоединение, называются неотделяемыми, в то время как префиксы радикалов, характеристических групп и префикс гидро- - отделяемыми. Сначала отделяемые префиксы располагают в ал фавитном порядке, а затем вставляют умножающие префиксы и локанты.
3.3.2 Заменительная номенклатура
Заменительная номенклатура применяется для формирования научных названий гетероциклических систем, а также ациклической родоначальной структуры соединения, состоящей из ряда неодинаковых фрагментов, соединенных друг с другом посредством гетероатомов. Основу названия родоначальной структуры по этой номенклатуре составляет название гипотетической открытой или циклической углеродной цепи (гептан или циклопентадиен, см. примеры 1 и 2 далее), которые получаются

заменой гетероатомов на атомы углерода. Причём в ациклической системе на атомы углерода заменяют лишь неконцевые гетероатомы (пример 1). К этому названию по порядку убывания старшинства добавляют неотделимые префиксы, указывающие на природу гетероатомов (а-обозначения элементов) и их локанты (3,6-оксаза + гептан → 3,6-оксазагептан в примере 1; 1,3-тиаза + циклопентадиен-2,4 → 1,3-тиазациклопентадиен-2,4 в примере 2); а-обозначения элементов образуются заменой окончания в их латинском названии на «а». Старшинство гетероэлементов в Периодической системе элементов уменьшается всерху вниз в группах и справа налево в периодах (кислород – самый старший, алюминий – самый младший в этом фрагменте системы), как показано ниже:
В настоящее время признана систематическая номенклатура ИЮПАК (IUРАС - Международный союз теоретической и прикладной химии).
Среди вариантов систематических номенклатур, рекомендуемых ИЮПАК, наиболее распространенной является заместительная номенклатура. В соединении выделяется некая основа, в которой произведено замещение атомов водорода на иные атомы или группы. Для понимания общих принципов построения названий органических соединений по заместительной номенклатуре необходимо в первую очередь усвоить номенклатуру углеводородов. Вместе с тем правила ИЮПАК позволяют употреблять названия органических соединений, построенные на основе устаревших тривиальной и рациональной номенклатур.
По правилам ИЮПАК название органического соединения строится из названия главной цепи, образующего корень слова, и названий функций, используемых в качестве приставок или суффиксов.
Для правильного построения названия необходимо провести выбор главной цепи и нумерацию атомов углерода в ней.
В заместительной номенклатуре название соединения представляет собой составное слово, корень которого включает название родоначальной структуры. Названия заместителей обозначаются префиксами (приставками) и суффиксами.
Заместитель - это любой атом или группа атомов, замещающих атом водорода в родоначальной структуре.
Функциональная группа - это атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определенному классу.
Характеристическая группа - это функциональная группа, связанная с родоначальной структурой. Для построения названия в первую очередь определяют тип характеристической группы (если она присутствует). Когда характеристических групп в соединении несколько, то выделяют старшую характеристическую группу. Для характеристических групп условно установлен порядок старшинства. В таблице эти группы приведены в порядке убывания старшинства. Затем определяют родоначальную структуру, в которую обязательно должна входить старшая характеристическая группа.
Префиксы и суффиксы для обозначения некоторых характеристических групп
* Атом углерода, заключенный в скобки, входит в состав главной углеродной цепи.
Как видно из таблицы, некоторые характеристические группы, а именно галогены, нитро- и алкоксигруппы, отражаются в общем названии только в виде префиксов, например бромметан, этоксиэтан, нитробензол.
Нумерацию атомов углерода в главной цепи начинают с того конца цепи, ближе к которому расположена старшая группа. Если таких возможностей оказывается несколько, то нумерацию проводят таким образом, чтобы либо кратная связь, либо другой заместитель, имеющийся в молекуле, получили наименьший номер.
В карбоциклических соединениях нумерацию начинают от того атома углерода, при котором находится старшая характеристическая группа. Если при этом невозможно выбрать однозначную нумерацию, то цикл нумеруют так, чтобы заместители имели наименьшие номера.
В группе циклических углеводородов особо выделяются ароматические углеводороды, для которых характерно наличие в молекуле бензольного кольца. Некоторые широко известные представители ароматических углеводородов и их производных имеют тривиальные названия, использование которых разрешено правилами ИЮПАК: бензол, толуол, фенол, бензойная кислота.

Радикал С 6 Н 5 -, образованный из бензола, называется фенил, а не бензил. Бензилом называют радикал С 6 Н 5 СН 2 -, образованный из толуола.
Составление названия органического соединения .
Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь (мет-, эт-, проп-, бут-, пент: гекс- и т. д.). Затем следует суффикс, характеризующий степень насыщенности, -ан, если в молекуле нет кратных связей, -ен при наличии двойных связей и -ин для тройных связей, (например пентан, пентен, пентин). Если кратных связей в молекуле несколько, то в суффиксе указывается число таких связей: -диен, -триен, а после суффикса обязательно арабскими цифрами указывается положение кратной связи (например, бутен-1, бутен-2, бутадиен-1,3):

Далее в суффикс выносится название самой старшей характеристической группы в молекуле с указанием ее положения цифрой. Прочие заместители обозначаются с помощью приставок. При этом они перечисляются не в порядке старшинства, а по алфавиту. Положение заместителя указывается цифрой перед приставкой, например: 3-метил; 2-хлор и т. п. Если в молекуле имеется несколько одинаковых заместителей, то перед названием соответствующей группы словом указывается их количество (например, диметил-, трихлор- и т. д.). Все цифры в названиях молекул отделяются от слов дефисом, а друг от друга запятыми. Углеводородные радикалы имеют свои названия.
Предельные углеводородные радикалы :

Непредельные углеводородные радикалы:
Ароматические углеводородные радикалы:

В качестве примера назовем следующее соединение:

1) Выбор цепи однозначен, следовательно, корень слова - пент; далее следует суффикс -ен, указывающий на наличие кратной связи;
2) порядок нумерации обеспечивает старшей группе (-ОН) наименьший номер;
3) полное название соединения заканчивается суффиксом, обозначающим старшую группу (в данном случае суффикс -ол указывает на наличие гидроксильной группы); положение двойной связи и гидроксильной группы указывается цифрами.
Следовательно, приведенное соединение называется пентен-4-ол-2.
Тривиальная номенклатура представляет собой совокупность несистематических исторически сложившихся названий органических соединений (пример: ацетон, уксусная кислота, формальдегид и т. д.).

Рациональная номенклатура позволяет строить название вещества на основании его структуры с более простым соединением, выбранным в качестве прототипа. Способ такого построения иллюстрируют следующие примеры:
Изомерия.
Выше было показано, что способность атомов углерода к образованию четырех ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава - изомеров. Все изомеры делят на два больших класса - структурные изомеры и пространственные изомеры.
Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов).
Пространственные изомеры имеют одинаковые заместители у каждого атома углерода и отличаются лишь их взаимным расположением в пространстве.
Структурные изомеры .
В соответствии с приведенной выше классификацией органических соединений по типам среди структурных изомеров выделяют три группы:
1) соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений:
2) соединения, отличающиеся углеродными скелетами:

3) соединения, отличающиеся положением заместителя или кратной связи в молекуле:

Пространственные изомеры (стереоизомеры) .
Стереоизомеры можно разделить на два типа: геометрические изомеры и оптические изомеры.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии геометрических изомеров. Геометрические изомеры отличаются своими физическими и химическими свойствами.

Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом.
Таким свойством обладают молекулы, имеющие асимметрический центр - атом углерода, связанный с четырьмя различными заместителями. Например, в виде двух оптических изомеров существует молекула молочной кислоты СН 3 СН(ОН)-СООН, содержащая один асимметрический центр.
Взаимное влияние атомов в молекуле. Молекула органического соединения представляет собой совокупность атомов, связанных в определенном порядке, как правило, ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности. Величины электроотрицательностей в значительной степени определяют такие важнейшие характеристики связи, как полярность и прочность (энергия образования). В свою очередь, полярность и прочность связей в молекуле в значительной степени определяют возможности молекулы вступать в те или иные химические реакции.
Электроотрицательность атома углерода зависит от состояния его гибридизации. Это связано с долей s-орбитали в гибридной орбитали: она меньше у sр 3 - и больше у sр 2 -и sр-гибридизованных атомов.
Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается в основном через систему ковалентных связей с помощью так называемых электронных эффектов.
Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой “дельта” (). Атом, “оттягивающий” электронную плотность -связи в свою сторону, приобретает отрицательный заряд . При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по -связи соответственно будет иметь равный по величине дефицит электронной плотности, т. е. частичный положительный заряд + , и будет называться электронодонором.
Смещение электронной плотности по цепи -связей называется индуктивным эффектом и обозначается I.
Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех -связей обозначается прямыми стрелками.
В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей.
Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода, проявляют отрицательный индуктивный эффект (-I-эффект).







