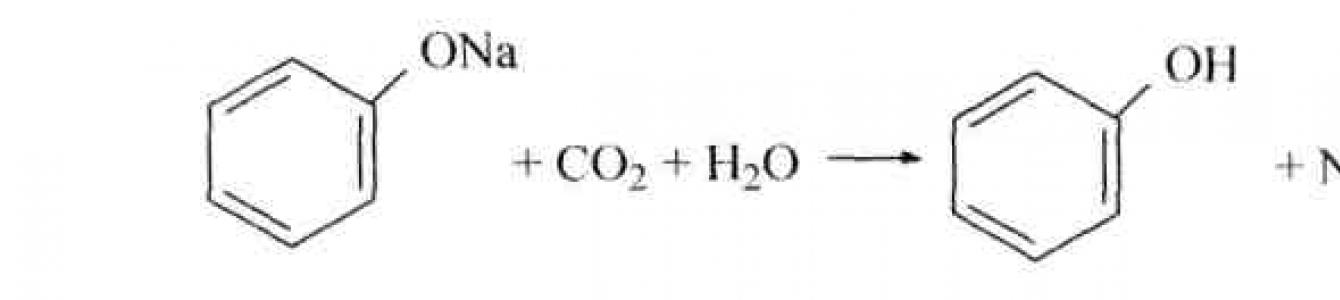1. Кислотные свойства. Фенолы - слабые кислоты, они слабее, чем угольная и карбоновые кислоты, со щелочами дают феноляты и воду:
но из растворов фенолятов фенолы вытесняются углекислым газом:

Приведенными реакциями пользуются при выделении фенолов из смеси с другими соединениями.
Фенолы, как и спирты, не изменяют окраски индикаторов, но кислотные свойства у них выражены хотя и слабо, но сильнее чем у воды и спиртов: С 6 Н 5 ОН > Н 2 0 > С 2 Н 5 ОН. У фенолов р-электроны кислорода входят в сопряжении с π-электронами ядра (энергия ~2 ккал/моль), увеличивая электронную плотность в орто- и пара-положениях. Это приводит к активации ядра в электрофильных реакциях замещения и к поляризации связи О←Н.
Кислотные свойства фенола усиливаются, если имеются электроноакцепторные группы, связанные с ядром, такие, как -N0 2 , -SO 3 H и др.

Например, в этом ряду пикриновая кислота (2,4,6-тринитрофенол) является самой сильной, по константе диссоциации приближается к минеральным кислотам.
89.
а) м-крезол + едкий калий; б) п-крезолят натрия + углекислота; в) тимол + едкий натр; г) пикриновая кислота + поташ; д) фенолят калия + углекислота; е) 2,4-динитрофенол + сода: ж) тимолят натрия + углекислота; з) п-крезол + едкий натр.
Качественная реакция на фенолы. Для открытия фенолов и енолов (енольных форм некоторых альдегидов и кетонов) используют цветную реакцию с водным раствором хлорного железа. Обычно появление окрашивания от синего до фиолетового указывает на присутствие фенолов, от кроваво-красного до василькового - алифатических енолов. В отличие от енолов фенолы лучше дают реакцию в присутствии воды:

90. Для фенолов, приведенных в упражнении 87, напишите уравнения цветной реакции с хлорным железом.
2. Реакция образования простых и сложных эфиров. Фенолы в отличие от спиртов труднее образуют простые и сложные эфиры. Простые эфиры фенолов получаются при действии на феноляты галогенпроизводных, в присутствии медного порошка:
Фенолы непосредственно карбоновыми кислотами не этерифицируются. Сложные эфиры фенолов и карбоновых кислот могут быть приготовлены действием ангидридов или галогенангидридов кислот на феноляты или на растворы фенолов в пиридине.

91. Напишите уравнения реакций и назовите продукты.
а) фенолят калия + метилбромид;
б) фенолят натрия + изопропилхлорид;
в) о-крезолят натрия + трет-бутилхлорид;
г) м-крезолят калия + уксусный ангидрид;
д) фенол (в пиридине) +уксусный ангидрид;
е) п-крезолят натрия + ацетилхлорид;
ж) п-крезол (в пиридине) + уксусный ангидрид;
з) п-крезолят натрия + уксусный ангидрид;
и) п-крезолят натрия + метилйодид;
к) м-крезолят натрия + метилбромид.
3. Реакция замещения гидроксила на галоген у фенолов идет труднее, чем у спиртов, ибо связь С-ОН у фенолов более прочная. Галогеноводороды на фенолы не действуют, a PCl 5 с небольшим выходом образует хлорбензол. Процесс осложняется побочными реакциями.
4. Восстановление фенолов в арены происходит при перегонке фенолов с цинковой пылью;
С 6 Н 5 - ОН + Zn → С 6 Н 5 + ZnO
92. Для фенолов, приведенных в упражнении 87, напишите уравнения реакций восстановления цинковой пылью. Назовите продукты реакции.
Среди многочисленных цветных реакций на фенольный гидроксил наибольшее распространение в фармакопейном анализе получило испытание с хлоридом окисного железа. Возникающее в результате реакции окрашивание обычно бывает синим или фиолетовым и зависит от заместителей. С. Вайбель указывает на установленные опытным путем «следующие закономерности, не являющиеся, однако, справедливыми во всех случаях»:
1) замещенные фенолы, имеющие две гидроксильные группы в ортоположении, дают зеленую окраску;
2) наличие карбоксильной группы в орто-положении к гидроксилу приводит к появлению фиолетовой окраски вместо синей,
3) если карбоксильная группа находится в пара-положении по отношению к гидроксилу, окраска становится желтой или красной, интенсивность окраски в первом случае увеличивается, а в последнем - уменьшается, п-оксикарбоновые кислоты могут также образовывать с хлорным железом желтые или красноватые осадки,
4) мета-замещенные фенолы обычно дают слабую цветную реакцию или вообще не окрашиваются, однако м-диоксибензол (резорцин) окрашивается в интенсивный фиолетовый цвет.
Разводят 1 мл 0,1% водного раствора адреналина 4 мл воды, прибавляют 1 каплю раствора хлорида окисного железа: сразу же возникает зеленое окрашивание, переходящее в вишнево-красное при прибавлении 0,5 мл разведенного аммиака. (Раствор адреналина гидрохлорида, ГФХ.)
Фенолы со свободным орто- или пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок и могут быть после перекристаллизации характеризованы по температуре плавления.
Так, трибромфенол, получающийся при бромировании фенола, после перекристаллизации из спирта и высушивания при 80° плавится при 92-95°.
Те же фенолы сочетаются с диазотированными первичными ароматическими аминами во всех случаях, когда замещения не находятся в мета-положении к аминогруппе или к другой оксигруппе.
Реакция описана выше при испытаниях на первичную ароматическую аминогруппу.
Многие фенолы со свободным пара-положением конденсируются с 4-хлорим,ин-2,6-дихлорхиноном с образованием окрашенных индофенолов. Индофенольная реакция может быть выполнена как в растворе, так и на фильтровальной бумаге.
Помещают по 1 мл 0,01% раствора в две пробирки, обозначенные соответственно А и Б, и прибавляют в каждую пробирку по 2 мл 20% раствора ацетата натрия. В пробирку А прибавляют 1 мл воды, в пробирку Б-1 мл 4% раствора борной кислоты и перемешивают. Охлаждают обе пробирки до 20° и быстро прибавляют в каждую пробирку по 1 мл 0,5% раствора 4-хлоримин-2,6-дихлорхино-на в спирте: в пробирке А возникает синее окрашивание, быстро исчезающее и переходящее через несколько минут в красное, в пробирке Б не возникает синего окрашивания. (Пиридоксина гидрохлорид. Международная фармакопея, Фармакопея США XVII.)
Специфичность общего для фенолов метода достигается в случае пиридоксина за счет реакции двух молекул пиридоксина с одной молекулой борной кислоты, вследствие которой образуется соединение, не реагирующее с хлор-хиноном.
Комплекс пиридоксина с борной кислотой
Последнее позволяет проводить контрольное определение, которое отличает пиридоксин от других фенольных соединений и от пиридоксамина и пиридоксаля, не имеющих оксиметиленовой группы в положении 4. Эта же реакция использована в X издании Государственной фармакопеи для испытания на отсутствие метилового эфира пиридоксина.
Фенолы переводят в ацетильные производные, нагревая вещество, растворенное в пиридине, с уксусным ангидридом.
0,2 г кипятят 5 минут с 1 мл уксусного ангидрида и 2 мл пиридина о колбе для ацетилирования. После охлаждения прибавляют 10 капель воды и после образования кристаллов еще 50 мл воды, колбу оставляют стоять при постоянном взбалтывании на 1 час. Фильтруют через стеклянный фильтр, промывая колбу,и фильтр 50 мл воды. Сушат фильтр при 105°. Температура плавления полученного диацетата 121- 124°. (Диэтилстильбэстрол, Скандинавская фармакопея.)
Таким же образом определяются дикумарин, флюорес-цеин и фенолфталеин, температуры плавления ацетилпро-изводных которых соответственно 262-271°, 202-207° и 147-150°.
Как и в случае ароматических аминов, бензоаты фенолов представляют собой твердые кристаллические вещества, имеющие характерную температуру плавления.
0,03 г растертого препарата растворяют в колбе с притертой пробкой емкостью 50 мл в 12 мл 5% раствора едкого кали, охлаждают до температуры не выше 10° и прибавляют 3-4 капли бензоилхлорнда. Раствор энергично взбалтывают, выделившийся осадок отфильтровывают на маленький стеклянный фильтр № 3 или № 4, промывают 1-2 мл воды, переносят в колбу емкостью 25 мл, снабженную воздушным холодильником, прибавляют 2 мл метилового спирта и нагревают на водяной бане при помешивании до полного растворения, а затем
охлаждают во льду. Выпавший осадок отфильтровывают и сушат 30 минут в сушильном шкафу при 100-105°. Температура плавления полученного бензоата этинилэстрадиола 199-202°. (Этинилэсградиол, ГФХ.)
Функциональный анализ органических лекарственных веществ
Подавляющую часть применяемых в медицинской практике лекарственных веществ составляют соединения органической природы. В отличие от анализа неорганических веществ, в котором используются свойства образующих их ионов, основу анализа органических лекарственных веществ составляют свойства функциональных групп.
Функциональные группы - это связанные с углеводородным радикалом отдельные атомы или группы атомов, которые вследствие своих характерных свойств могут быть использованы для целей идентификации и количественного определения лекарственных веществ.
Наличие нескольких функциональных групп оказывает влияние на эффекты некоторых общих реакций и на свойства продуктов, образующихся в результате их протекания.
Классификация функциональных групп
1. Кислородсодержащие функциональные группы:
ОН - гидроксильная (спиртовая или фенольная);
С=О; -С=О - карбонильная (кетонная или альдегидная);
СООН - карбоксильная;
C-О- - сложноэфирная группа;
CH-(CH 2) n -C=O – лактонная группа.
NH 2 - первичная аминогруппа алифатическая или ароматическая;
NO 2 - ароматическая нитрогруппа;
NH- - вторичная аминогруппа;
N- - третичный атом азота;
C-NH- - амидная группа;
CH-(CH 2) n -C=O – лактамная группа;
С-NH-C- - имидная группа;
SO 2 -NH- - сульфамидная группа;
СН = N- - азометиновая группа;
3. Прочие функциональные группы:
Ароматический (фенильный) радикал;
 - пиридиновый цикл;
- пиридиновый цикл;
R―Gal - ковалентно-связанный галоген (Cl, Br, I, F);
R―S― - ковалентно-связанная сера.
Спиртовый гидроксил: Alk - ОН
Спиртовый гидроксил - это гидроксил, связанный с алифатическим углеводородным радикалом. Его содержат спирты, карбоновые кислоты и их соли, терпены, производные фенилалкиламинов, соединения стероидного строения, антибиотики ароматического ряда и некоторых другие лекарственные вещества.
Идентификация
1. Реакция этерификации с кислотами или их ангидридами в присутствии водоотнимающих средств. Основана на свойстве спиртов образовывать сложные эфиры. В случае низкомолекулярных соединений эфиры обнаруживают по запаху, а при анализе высокомолекулярных веществ - по температуре плавления.
С 2 Н 5 ОН + СН 3 СООН + Н 2 SО 4 к. → СН 3 -С = О + Н 2 О
спирт этиловый этилацетат (фруктовый запах)


2. Реакция окисления. Основана на свойстве спиртов окисляться до альдегидов, которые обнаруживают по запаху. В качестве реагентов используют различные окислители: калия перманганат, калия бихромат, калия гексацианоферрат (III) и др. Наибольшую аналитическую ценность имеет калия перманганат, который, восстанавливаясь, меняет степень окисления от
7 до +2 и обесцвечивается, т.е. делает реакцию наиболее эффектной.
С 2 Н 5 ОН + [О] → СН 3 -С=О + Н 2 О
спирт этиловый ацетальдегид (запах яблок)
Окислению могут сопутствовать побочные химические реакции. Например, в случае эфедрина - гидраминное разложение, в случае молочной кислоты – декарбоксилирование.
3. Реакция комплексообразования , основанная на свойстве многоатомных спиртов образовывать комплексные соединения с сульфатом меди (II) в щелочной среде.
CuSO 4 + 2 NaOH → Cu(OH) 2 + Na 2 SO 4

глицерин синего цвета комплекс
Аналогичную цветную реакцию дают аминоспитры (эфедрин, мезатон и др.). В комплексообразовании принимают участие спиртовый гидроксил и вторичная аминогруппа. Полученные окрашенные комплексы имеют структуру:

В случае эфедрина образующийся комплекс при извлечении в эфир окрашивает его в фиолетово-красный цвет, а водный слой сохраняет синее окрашивание.
Количественное определение
1. Метод ацетилирования: алкалиметрия, вариант нейтрализации, способ косвенного титрования. Основан на свойстве спиртов образовывать нерастворимые сложные эфиры. Ацетилирование проводят избытком уксусного ангидрида при нагревании в присутствии пиридина. В процессе титрования выделяется эквивалентное количество уксусной кислоты, которую оттитровывают натрия гидроксидом с индикатором фенолфталеин.
СН 2 -ОН СН 2 -О-COCH 3
СН -ОH + 3 (СH 3 CO) 2 O → СН -О-COCH 3 + 3 CH 3 COOH
СН 2 -ОН СН 2 -О-COCH 3
Одновременно будет титроваться также кислота, образованная при гидролизе избытка уксусного ангидрида, взятого для ацетилирования, поэтому необходим контрольный опыт.
(СH 3 CO) 2 O + H 2 O → 2 СH 3 COOH
СH 3 COOH + NaOH → СH 3 COONa + H 2 O Э=М/3
2. Бихроматометрия . Метод основан на окислении спиртов избытком бихромата калия в кислой среде. При этом спирт этиловый окисляется до уксусной кислоты, глицерин – до углекислоты и воды. Окислении проходит во времени и поэтому используют способ обратного титрования.
3 C 2 H 5 OH + 2 K 2 Cr 2 O 7 + 16 HNO 3 → 3 CH 3 COОН + 4 Cr(NO 3) 3 + 4 KNO 3 + 11 H 2 O
Избыток бихромата калия определяют йодометрически с индикатором – крахмал:
K 2 Cr 2 O 7 + 6 KJ + 14 HNO 3 → 3 J 2 + 2 Cr(NO 3) 3 + 8 KNO 3 + 7 H 2 O
J 2 + 2 Na 2 S 2 O 3 → 2 NaJ + Na 2 S 4 O 6 Э=М/4
3. Куприметрия . Метод основан на свойстве спиртов образовывать устойчивые комплексные соединения с сульфатом меди в щелочной среде. Прямое титрование. Титрант – сульфат меди. Индикатор – мурексид. Метод используется во внутриаптечном контроле качества лекарственных форм с левомицетином.
Фенольный гидроксил: А r - ОН
Это гидроксил, связанный с ароматическим радикалом. Его содержат лекарственные вещества группы фенолов, фенолокислот и их производных, производные фенантренизохинолина, синэстрол, адреналин и др.
Идентификация
1. Реакция комплексообразования фенольного гидроксила с ионами железа (III). Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий цвет (фенол) или фиолетовый (резорцин, кислота салициловая), реже в красный (ПАС-натрий) и зеленый цвета (хинозол).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов: синий (фенол) или фиолетовый (резорцин), влиянием других функциональных групп (кислотата салициловая, ПАС-натрий, хинозол), реакцией среды (резорцин).
кислота салициловая
2. Реакция бромирования ароматического кольца. Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного белого цвета. При избытке бромной воды образуется продукт окисления и галогенирования (тетрабромциклогексадиен-2,5-он) в виде осадка желтого цвета.
чем больше стерический фактор. При исследовании взаимодействия противоокислителей фенольного типа с активными ал-кильными и пероксидными радикалами предполагали, что водород отрывается от фенольной группы и образуются фенок-сильные радикалы С6Н5О-, переходящие в дальнейшем в неактивные соединения. Этот переход может происходить при взаимодействии как собственно феноксильных радикалов по типу С6Н5О-ОС6Нб, так и изомерных им радикалов с хиноидной структурой:
Образование феноксильных радикалов из фенолов в условиях окисления зафиксировано методом ЭПР. В условиях окисления феноксильные радикалы подвергаются дальнейшим превращениям.
Радикалы ингибитора могут реагировать и друг с другом. Рекомбинация феноксильных радикалов приводит к димерам.
Реакция In-4-In-. Достаточно подробно изучена рекомбинация феноксильных радикалов. Как правило, реакция протекает в несколько стадий. Феноксильные радикалы ионола рекомби-нируют по двум параллельным направлениям:
Образование феноксильных радикалов по этой реакции доказано методом ЭПР на примере 2,4,6-три-грег-бутилфенола. Вероятность выхода образующихся радикалов в объем при взаимодействии кумилгидропероксида с 4-метоксифенолом равна 27% .
Равновесие сдвинуто в сторону образования феноксильных радикалов. Поэтому в реакции окисления вначале расходуется фенол, а затем амин. Синергизм является результатом более эффективного обрыва цепей двумя ингибиторами из-за удачного сочетания высокой эффективности ароматического амина в актах обрыва цепей с низкой активностью феноксила в реакции продолжения цепей.
Эффективность алкилфенольных антиокислителей в основном зависит от стабильности феноксильного радикала, образующегося в процессе окисления, и от степени полярности гидроксильной группы. Стабильность феноксильных радикалов возрастает по мере увеличения степени пространственного экранирования их
алкильными радикалами, находящимися в положении 2 и 6. При этом экранирующая способность алкильных радикалов повышается с увеличением их объема, например от метильного к грег-бутиль-ному. Полярность гидроксильной группы в алкилфенолах зависит от характера алкильных заместителей в пара-положении: элек-тронодонорные заместители снижают полярность, а электроноак-цепторные - повышают. Несмотря на то что электронодонорная способность алкильных радикалов в пара-положении возрастает с удлинением цепи, экспериментальные исследования показали, что наибольшей стабилизирующей активностью обладают алкилфенолы с метальным радикалом в пара-положении к гидроксильной группе. Отсюда можно заключить, что активность алкилфенольных соединений зависит и от других факторов, в частности предполагается, что при окислении определенную роль играют продукты превращения первичных феноксильных радикалов.
Различия в синергетическом эффекте исследованных антиокислителей объясняют разной реакционной способностью образующихся феноксильных радикалов PhO-. Чем менее устойчив этот радикал, тем больше скорость его взаимодействия с амином. В соответствии с этим отмечается различная скорость расходования амина в присутствии фенолов на начальных участках кинетических кривых. На основании данных о кинетике расходования исследованные фенольные антиокислители по стабильности радикалов располагаются в следующий ряд: 2,6-ди-т/7ег-бутилфеноксид ^ 2-метил-6-т/7ег-бу-тилфеноксид ^2,6-дициклогексилфеноксид. Этот ряд находится в соответствии со значениями стерических констант Тафта: для метального es=0, для циклогексиль-ного - 0,79 и для трег-бутильного - 1,54 . Поэтому
Окисление в режиме автоокисления идет с образованием свободных радикалов по реакциям вырожденного разветвления цепи, что приводит к росту суммарной скорости окисления ароматических углеводородов. По мере накопления соединении типа фенолов, обладающих способностью реагировать со свободными радикалами с образованием неактивных феноксильных радикалов, скорость окисления ароматических углеводородов постепенно падает и процесс окисления "затухает" .
В цитированной выше работе показано, что механизм действия фенольных ингибиторов не исчерпывается заменой активного радикала R" неактивным феноксильным радикалом. В присутствии ингибитора могут происходить превращение радикала R02°B устойчивую гидроперекись и рекомбинация феноксильных радикалов в соответствующие хиноны.
В экранированных фенолах фенольный гидроксил малоактивен вследствие стерическнх препятствий. В данном случае 2,6-ди-гареот,-бутил-4-метилфснол,)))"де фенольный гидроксил экранирован двумя радикалами mpem-бутила, теряет фенольные свойства и не реагирует со щелочами, щелочными металлами, уксусным ангидридом. Он реагирует только с реактивом Гриньяра. В то же время изомерный 2,4-ди-трет-бутил-З-метилфенол, являясь криптофенолом, обладает всеми свойствами фенолов.
Широкое использование в качестве антиокислителей смазочных масел, нашли органические соединения, содержащие азот п фенольный гидроксил, Исследования показали, что в ряде слу-
Некоторые производные аминов, амидов и мочевины применяют для уменьшения летучести органических продуктов, что имеет большое значение для смазочных масел в сверхзвуковой авиации. Производные мочевины, содержащие экранированный фенольный гидроксил, например 3,5-ди-трег-бу-тил-4-гидроксибензилмочевина, обладают антиокислительными и диспергирующими свойствами при высокой температуре ".
Сложнее связать принадлежность антиокислителя к той или иной кинетической группе с его химической структурой и наличием в нем тех или иных функциональных групп. Сама по себе химическая природа функциональной группы, по данным К. И. Иванова и Е. Д. Вилянской, не определяет, к какой группе принадлежит антиокислитель. Соединения с аминными или фенольными группами входят, например, во все три группы антиокислителей. Дифениламин принадлежит к 1-й группе, а-нафтиламин-ко 2-й,)3-нафтиламин-к 3-й. Большее значение имеет, очевидно, положение функциональных групп в молекуле антиокислителя. Так, например, отличительной особенностью строения замедлителей 2-й группы, принадлежащих к классам ароматических аминов, фенолов или аминфенолов, является то, что аминная группа в них имеет первичный характер и находится, как и фенольный гидроксил, только в активных а- или пара-положениях. Изомерные им соединения, где эти же функции присутствуют в менее реакционноспособных /?-, а также ортпо-и./иетпя-положениях, реагируют как представители 3-й группы ингибиторов. Когда же в антиокислителе 2-й группы - п-аминофеноле-активная аминогруппа утрачивает свой первичный характер в результате введения в нее фенильного или нафтиль-ного радикалов, то получающиеся аминофенолы реагируют уже как замедлители 1-й группы, в которую входят и вторичные ароматические моноамины. Все эти теоретические предположения имеют большое практическое значение, так как в будущем должны позволить отойти от того сугубого эмпиризма, который существует в области подбора антиокислительных присадок. Становится также очевидной возможность стабилизации масел не только свежих, т. е.до загрузки их в агрегат, но и масел, находящихся в эксплуатации и в значительной мере отработанных. Следует отметить, что эффективность некоторых антиокислителей по отношению к изношенным энергетическим маслам описана в литературе достаточна давно, однако впервые делается попытка дать этому явлению известное обоснование.
При этом роль протонодонора играет фенольный гидроксил, так
фенольный гидроксил...... Диоксибензойные и, содержащие карбоксил......... Галловая, содержащая карбоксил. . Кспюкис.югпы Ацетоуксусная.......... 4,10.10-14; 4,80-Ю-10 5, 00- Ю-2; 3,30-10-5 3,90-10-5 2 62 -Ю-4 13,40; 9,32 1,30; 4,48 4,41 3,58
Heredy впервые предложил использовать воздействие на угли фенола в присутствии BF3, предполагая, что это приведет к разрушению алифатических "мостиков" между фрагментами. Исследования, проведенные на модельных веществах, показали, что реакция легко осуществляется при 100 °С, если один из ароматических фрагментов содержит фенольный гидроксил. Малометаморфизованные угли после такой обработки растворяются в феноле и пиридине на 70-80%. При использовании фенола, содержащего 1ЭС, было установлено, что происходит также алкирование фенола алкильными группами угля. После нагревания угля со смесью этого фенола и ВРз значительная часть алкилфенолов, содержащихся в продуктах реакции, была представлена р-изопропилфенолом, образовавшимся при алкилнровании радиоактивного фенола изолролнльными группами угля. Аналогичные процессы происходят при нагревании углей с фенолом в присутствии р-толуолсульфокислоты при температуре кипения фенола в токе азота. Из растворимых в бензоле продуктов после их метилирования были выделены и идентифицированы следующие продукты:
В результате эффекта сопряжения за счет электронов атома кислорода электронная плотность в орто- и «ара-положениях.ароматического ядра возрастает и не только облегчается отрыв водородного атома гидроксильной группы, но и активируется бензольное кольцо. Фенольный гидроксил является одним из силь-мейших орго-гсара-ориентиров, а в щелочной среде - сильнейшим.".
Интересно отметить, что и-оксибензойная кислота, так же как и ее сложный этиловый эфир, с циклогексеном и циклопентеном в присутствии BF3 при 50° образуют соответствующие тг-циклоалкоксибензойные кислоты, т. е. фенольный гидроксил в данном случае, вероятно, более реакционноспособен, чем карбоксильная группа.
Остальную массу соединений в этих концентратах составляют, по-видимому, гетероароматические конденсированные соединения. Об этом свидетельствует интенсивное поглощение ароматических структур в ИК-спектрах и высокое содержание азота и серы в выделенных концентратах - в них из исходного деясфальтизата извлечено IO
Кислотные свойства.
Большая подвижность атома водорода гидроксильной группы фенолов по сравнению со спиртами предопределяет и их большую кислотность. Доказательством большей кислотности фенолов по сравнению со спиртами является то, что фенол и его производные реагируют с водными растворами щелочей, образуя соли, называемые феноксидами. Феноксиды сравнительно устойчивы и в, отличие от алкоголятов, могут существовать в водных щелочных растворах. Однако при пропускании через такой раствор тока диоксида углерода феноксиды превращаются в свободные фенолы. Эта реакция доказывает, что фенол является более слабой кислотой, чем угольная кислота.
1. Фенолы могут взаимодействовать:
а) со щелочными металлами:
б) со щелочами:
Соли фенолов (феноляты) легко разлагаются минеральными кислотами, даже угольной:
Реакции нуклеофильного замещения.
В связи с +М -эффектом гидроксильной группы фенолы являются более слабыми нуклеофилами, чем спирты.
Взаимодействие с галогенопроизводными. Учитывая слабые нуклеофильные свойства, в реакциях нуклеофильного замещения используют обычно не сами фенолы, а их соли – феноксиды щелочных металлов. При взаимодействии феноксидов с алкил и арилгалогенидами образуются простые эфиры фенолов.
1. Алкилирование (образование простых эфиров):
2. Ацили
При действии на фенолы хлорангидридов или ангидридов карбоновых кислот образуются сложные эфиры. В отличие от спиртов фенолы не образуют сложных эфиров при действии на них карбоновых кислот. 
Взаимодействие с FeCl 3 (качественная реакция на фенол)

Реакции углеводородного радикала.
Ранее было отмечено, что гидроксильная группа в фенолах проявляет +М-эффект и ведёт себя как электронодонор по отношению к бензольному кольцу. Она является ориентантом I рода и направляет атаку электрофильных реагентов в орто -и пара - положения бензольного кольца. Благодаря электронодонорному влиянию гидроксильной группы фенолы вступают в реакции электрофильного замещения легче, чем бензол.
Реакции, идущие по бензольному кольцу.
Влияние атомов взаимно. Гидроксильная группа влияет на бензольное кольцо. Водородные атомы становятся подвижными в орто- и пара- положении и замещаются на другие атомы и радикалы:
а) галогенирование (реакция с бромной водой):
 Эта реакция используется для качественного обнаружения и количественного определения фенолов.
Эта реакция используется для качественного обнаружения и количественного определения фенолов.
б) нитрование:

в) сульфинирование:

По правилам ИЮПАК сульфогруппа старше, чем гидроксильная группа, поэтому продукты сульфирования называются сульфокислотами.
Г) окисление фенолов.
Фенолы легко окисляются под действием кислорода воздуха:

№30.Фенол, резорцин, пирокатехин, гидрохинон, применение в медицине.
а)С 6 Н 5 - ОН (фенол). - Бесцветное кристаллическое вещество с резким характерным запахом. При хранении окисляется кислородом воздуха, приобретая розовую окраску. Плавится при 42,3ºС, кипит при 182ºС, частично растворим в воде (6г в 100г воды). Обладает сильным антисептическим свойством, ядовит. При действии на кожу обжигает, образуя волдыри, язвы. 3% раствор фенола в воде называется карболовой кислотой и применяется как дезинфицирующее средство. Применяется для синтеза красителей, пластмасс, лекарственных препаратов.
б)Гидрохинон- содержится в толокнянке, легко окисляется, поэ тому используют в фотографии в качестве проявители.
в)Пирокатехин - кристаллическое вещество, темнеющее при хранении, используют как проявитель в фотографии, в синтезе красителей, пластмассе, лек-х преп.-ов.
г) Резорцин- кристаллическое вещество, темнеющее на воздухе, применяется как антисептик в производстве красителей, пластмасс.
№31.Оксосоединения. Электронное строение оксо-группы. Номенклатура альдегидов и кетонов. Способы получения альдегидов.