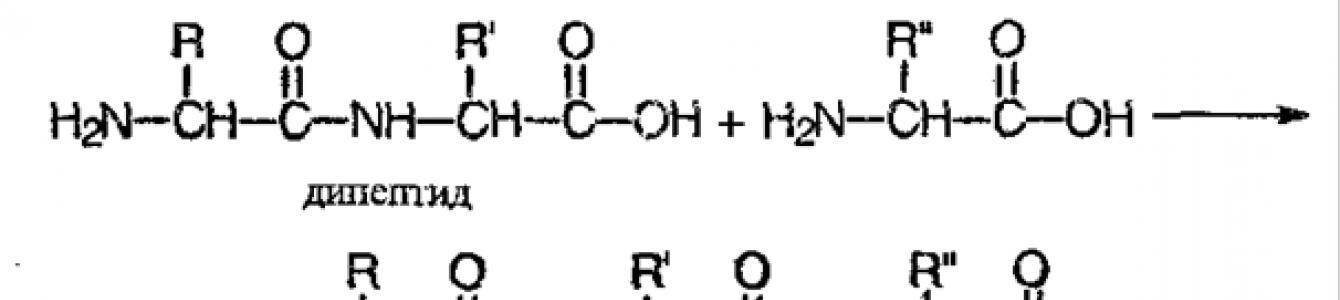Эти фрагменты связаны пептидной связью:
Это соединение называется дипептидом . При этом дипептид может реагировать еще с одной аминокислотой, образую трипептид :

Формулы пептидов з аписывают так, чтобы свободная аминогруппа находилась слева, а свободная карбоксильная группа - справа.
Структуру пептидов записывают в сокращенном виде (если в пептиде много остатков аминокислот). Например, вазопрессин:
Эту же структуру можно написать в сокращенном виде:
Химические свойства пептидов.
Основным свойством пептидов является их способность к гидролизу . При гидролизе происходит полное или частичное разрушение цепи, после чего образуются пептиды более короткого строения. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Гидролиз может быть кислотным и щелочным, а также может протекать под действием ферментов. В кислой и щелочной среде образуются соли аминокислот, а ферментативный процесс протекает селективно, т.к. можно расщепить конкретные фрагменты цепи пептида.
Биологическое значение пептидов.
Многие пептиды проявляют свою биологическую активность. Простейший пептид - глутатион, который относится к классу гормонов. Он построен из остатков глицина, цистеина и глутаминовой
На рис. 4.1 изображен трипептид, состоящий из аминокислотных остатков аланина, цистеина и валина. Отметим, что трипептид содержит три остатка, но не три пептидные связи.
Рис. 4.1. Структурная формула трипептида. Пептидные связи для наглядности затенены.
Структуру пептида принято изображать так, чтобы N-концевой остаток (содержащий свободную а-аминогруппу) располагался слева, а С-концевой остаток (со свободной а-карбоксильной группой) - справа. Такой пептид имеет только одну свободную а-аминогруппу и только одну а-карбоксильную группу. Это справедливо для всех полипептидов, которые образованы только аминокислотными остатками, соединенными друг с другом пептидными связями, образовавшимися между а-аминогруппой и а-карбоксильной группой. В некоторых пептидах концевая аминогруппа или концевая карбоксильная группа модифицирована (примером могут служить ацильное производное аминогруппы или амид карбоксильной группы) и, таким образом, не является свободной.
Запись структурной формулы пептидов
Укажем самый простой способ записи. Во-первых, нарисуем «остов» из связанных друг с другом и из атомов а-углерода. Эти группы чередуются вдоль остова цепи. Затем подсоединим к a-углеродным атомам соответствующие боковые группы. Опишем эту процедуру подробнее.
1. Вычертим зигзагообразную линию произвольной длины и добавим слева N-концевую аминогруппу:
2. Встроим в цепочку а-углеродные атомы, а-карбоксильную и а-аминную группы:

3. Присоединим соответствующие -группы (они затенены) и атомы а-водорода к а-углеродным атомам:


Рис. 4.2. Представление первичной структуры гексапептида с помощью трехбуквенных и однобуквенных обозначений аминокислотных остатков. Данный гексапептид содержит на N-конце глутамат (Glu. Е). а на С-конце аланин
Первичная структура пептида
Линейная последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой пептида. Чтобы определить первичную структуру Полипептида, нужно установить число, химическую структуру и порядок расположения всех аминокислотных остатков, входящих в его состав.
Полипептиды (белки) могут содержать 100 и более остатков, поэтому традиционные структурные формулы оказываются неудобными для представления первичной структуры. «Химическая скоропись» использует либо трехбуквенные, либо однобуквенные обозначения аминокислот, выписанные во втором столбце табл. 3.3 (рис. 4.2). При наименовании пептида его рассматривают как производное С-концевого аминокислотного остатка.
Если первичная структура однозначно установлена, то трехбуквенные обозначения аминокислотных остатков соединяют черточками. Однобуквенные обозначения черточками не соединяют. Если на каком-то участке полипептидной цепи точный порядок следования аминокислотных остатков неизвестен, эти остатки заключают в скобки и разделяют запятыми (рис. 4.3).
Рис. 4.3. Гептапептид, содержащий участок, точная первичная структура которого не установлена.
Физиологические последствия изменений в первичной структуре
Замена всего одной аминокислоты на другую в линейной последовательности из 100 и более аминокислот может привести к снижению или полной потере биологической активности пептида, а это повлечет за собой весьма серьезные последствия (в качестве примера можно привести серповидноклеточную анемию; см. гл. 6). Многие наследуемые нарушения метаболизма обусловлены именно одиночными заменами такого типа. С развитием новых мощных методов определения структуры белков и ДНК удалось выяснить биохимическую основу многих наследуемых болезней, связанных с нарушениями метаболизма.
О: а) образуют связь – гидрофобная связь, т.к. обе аминокислоты гидрофобные
б) образуют связь – дисульфидная связь за счет SH
в) образуют связь – ионная связь, т.к. кислая и основная аминокислоты
г) не образуют связи
Напишите формулу трипептида: лиз-арг-гис. В какой среде находится его ИЭТ? Ответ обоснуйте.
О: ИЭТ – это значение pH, при котором заряд белка стремится к нулю. В этом трипептиде все аминокислоты основные. А значит ИЭТ в щелочной среде.
Напишите формулу трипептида: глу-асп-ала. Определите его заряд в нейтральной среде. Как изменится заряд в кислой среде? Растворимость? Почему?
О: Глу и асп – кислые аминокислоты, ала – гидрофобная. При рН =7 заряд трипептида отрицательный. В кислой среде (при добавлении протонов Н +) заряд будет уменьшаться, т.е стремиться к ИЭТ. При уменьшении заряда уменьшается и растворимость.
Трипептид: вал-лей-ала. Уточните его способность растворяться в воде. Почему?
О: Трипептид образован гидрофобными аминокислотами, между радикалами которых образуются гидрофобные связи. Поэтому в воде не растворяется.
Два пациента больны дизентерией. У одного величина белкового коэффициента – 0,9, у другого – 1,9. Какова тактика врача в обоих случаях?
О: Дизентерия – это инфекционное заболевание. Обусловленное внедрением в макроорганизм микроорганизма.
БК – это соотношение альбуминов к глобулинам в сыворотке крови. БК= [А]/[Г]=1,5 – 2,3. При внедрении микроорганизма запускается гуморальный иммунитет, что обуславливает выработку гамма-глобулинов. При увеличении глобулинов в крови значение БК уменьшается – значит организм борется с инфекцией- как у первого пациента. Во втором случае БК=1,9, т.е гамма-глобулины не вырабатываются, а значит организм не борется с микроорганизмом. Следовательно, состояние хуже у второго больного. В первом случае – врач назначает антибиотики, которые действуют на мембрану микроба, проникают внутрь клетки, действуют на ДНК микроорганизма, тем самым не позволяя размножаться. Во втором случае назначают иммуностимуляторы- взрослым, а детям и старикам – вводят готовые антитела. Так же и в 1ом и во 2ом случаях дают водно-солевые растворы для предотвращения обезвоживания.